
题目列表(包括答案和解析)
31.(16分)糖尿病被称为人类健康的“第三杀手”,它是由于胰岛素分泌不足引起的。胰岛素是一种激素,哺乳动物体内都有胰岛素,且生理作用相同。请通过实验证明胰岛素的生理作用。
实验材料:两只发育良好的白鼠,甲、乙两试管,新配制的Cu(OH)2溶液。
实验原理:胰岛素具有 作用,去掉胰腺的白鼠血糖会 ,可用现配制的斐林试剂来检验尿液。
实验步骤:(注:用其尿液进行实验验证。)
第一步:用手术摘除一只白鼠的胰腺(不考虑其对消化功能的影响),另一只白鼠不做任何处理,在相同条件下饲养一段时间。
第二步:分别取两只鼠的 ,分别注入甲、乙试管内。。
第三步:用现配制的斐林试剂,分别取等量注入两支试管,观察颜色变化。
预测结果:
。
实验结论:如果实验结果与 相符,则证明 。
分析思考:
⑴上述实验中的对照组是 。
⑵从选材角度来看上述实验的白鼠的选取还应注意小鼠的 。
30.(12分)回答下面与家蚕有关的遗传学问题:
⑴家蚕的性别决定与XY型相反,属于ZW型。现有2组家蚕,每组中均有肤色正常蚕和皮肤油性蚕(相关基因分别为Os、os),且雌雄各一半。请根据各组家蚕交配的子代情况在下表中填写出B组亲本的基因型:
|
|
亲本 母本(基因型)×父本(基因型) |
子代 |
|
|
♀ |
♂ |
||
|
A组 |
ZosW×ZOsZOs |
正常蚕 |
正常蚕 |
|
B组 |
× |
正常蚕、油蚕 |
正常蚕、油蚕 |
⑵因为雄蚕比雌蚕体质强、出丝率高,所以尽早鉴别了蚕的雌雄在蚕种生产上具有明显的经济意义。科学家运用染色体工程学方法将第10号染色体上的黑卵基因转移(易位)到了W染色体上,这样可以借助光电自动选卵机将后代中 色的 卵(雌/雄)杀死,留下 色的 卵。蚕卵的这种颜色变异在遗传学上称为 变异。
29.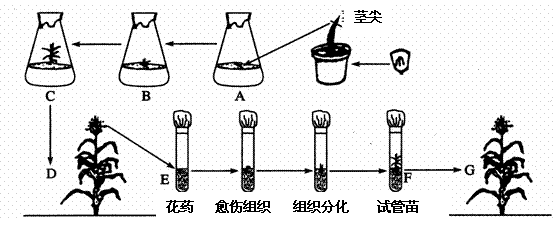 (20分)下面是有关改变生物性状的一些实验方法,请分析并回答下列各题:
(20分)下面是有关改变生物性状的一些实验方法,请分析并回答下列各题:
⑴.取玉米幼苗的茎尖进行组织培养如图A-C,发育成植株D,取D的花药进行离体培养,幼苗经处理后如图E-F,又发育成为植株G。
①从生殖方式上分析:D→F属于 生殖。
②从结构上看:该植物叶片的维管束鞘细胞含有 。
③从细胞分裂方式上分析:A→C过程中进行了 分裂、D→F过程中进行了 分裂。
④从营养液的配备来看;除都应加 等营养物质外,还应加入 等激素。
⑤从技术操作中看:在E→G过程中经过 和 两步骤,以得到可育的玉米植株。
⑵.设小白鼠的体细胞染色体组成为AA+XX,人的体细胞染色体组成为BB+XY,如果用人的淋巴细胞和小白鼠的骨髓瘤细胞进行细胞融合,得到的融合细胞含有4个染色体组,融合细胞的染色体组成可能是 。(只考虑两个细胞融合)
⑶.搭载“神州x号”飞船的种子在微重力和宇宙射线的作用下,易发生基因突变。科学家在此实验中一般会选择萌发的种子而不是休眠的种子,其原因是 。
28.(15分)
 t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2
( g ) +O2 ( g ) 2 SO3
(g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2
( g ) +O2 ( g ) 2 SO3
(g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
(1)从反应开始至达到化学平衡,生成SO3平均反应速率为_____________;平衡时SO2转化率为__________________。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n molSO2的同时生成n mol O2
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是_________________
A.向容器中通人少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)t℃时,若将物质的量之比n(SO2):n(O2)= 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20 %。SO2的转化率为________。
27.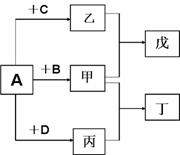 (15分)短周期元素a、b、c、d的原子序数依次增大,
(15分)短周期元素a、b、c、d的原子序数依次增大,
它们分属于不同主族,这四种元素的原子电子层数之和
为8。A、B、C、D依次是a、b、c、d的单质,在一定
条件下可以发生如图所示的化合反应:
甲、乙、丙分子内原子数依次为4、3、2。
(1)将甲和丙两气体混合后产生白烟,则丁的化
学式是___________,若将甲通入乙中所得
溶液pH 大于7,则乙的化学式是_______________。
(2)甲、乙、丙三分子中,电子数相同的是_____________(填化学式);甲与乙等物质的量化合而成戊,戊的化学式为_____________。
(3)高温时,甲与C在催化剂作用下加热可以发生反应。该反应是工业生产某强酸的重要环节,此反应的化学方程式为_______________________________
(4)甲+D --→丁+B,写出该反应的化学方程式______________________
(5)若甲溶液和溶液的pH之和等于14,两溶液等体积混合.所得溶液pH_______7(填“>”或“<”或“=”)。
(6)写出一种由a、b、c、d四种元素组成的化合物的化学式________________,该化合物构成的晶体是___________________晶体(填晶体类型)。
26.(15分)某校化学课外活动小组为探究氮的化合物的性质,设计了如下图所示实验。A处是气体发生装置,A中所用实验药品从下列物质中选取:
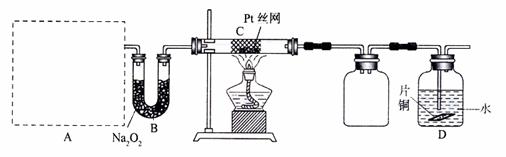 ①Na2CO3 ②NaHCO3 ③NH4HCO3 ④NH4Cl ⑤Ca(OH)2 ⑥浓氨水 ⑦NaOH
①Na2CO3 ②NaHCO3 ③NH4HCO3 ④NH4Cl ⑤Ca(OH)2 ⑥浓氨水 ⑦NaOH
按上图连势头好各仪器,先将C处Pt丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯。部分实验现象如下:Pt丝继续保持红热,D中Cu片慢慢溶解。回答下列问题:
(1)若A中制取气体时只用一种药品,该药品为 (填前述备选药品的序号),则制取气体所用到的玻璃仪器有 。
(2)B装置的作用为 。
(3)写出C中发生反应的化学方程式 。
(4)D中Cu片发生反应的离子方程式为 。为了使Cu片溶解的速度明显加快,可向D处的溶液中加入下列物质中的 (填下列各项序号)。
a.Na2CO3 b.AgNO3 c.CuSO4 d.FeSO4
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进谈谈你的意见: 。
25.已知一个碳原子上连有两个羟基时,易脱水形成碳氧双键。请根据下图回答。

(1) E中含有的官能团的名称是_____________,反应②的反应类型是________________,
C跟新制的氢氧化铜反应的化学方程式为 。
(2) 已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为______________,F的分子式为______________。
(3) 在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11 μm线宽芯片的关键
技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G
可能有________种结构,写出其中任一种同分异构体的结构简式________________。
11.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(A-)>c(OH―)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+c(OH-)
|
的硫酸试剂标签上的部分内容。据此下列
说法正确的是 ( )
A.该试剂的物质的量浓度9.2mol·L-1
B.该硫酸50mL与足量的铜反应,被氧
化的铜的物质的量为0.46mol
C.配制250mL4.6mol·L-1的稀硫酸需取
该硫酸62.5mL
D.该硫酸与等体积的水混合所得溶液的质
量分数小于49%
10.下列离子方程式的书写中,正确的是 ( )
 A.电解饱和食盐水:2Cl-+ 2H+ H2↑+ Cl2↑
A.电解饱和食盐水:2Cl-+ 2H+ H2↑+ Cl2↑
 B.碳酸钠溶液与醋酸溶液混合:CO32- + 2H+ CO2↑+ H2O
B.碳酸钠溶液与醋酸溶液混合:CO32- + 2H+ CO2↑+ H2O
 C.氢氧化亚铁与稀硝酸混合:Fe(OH)2
+ 2H+ Fe2+
+ 2H2O
C.氢氧化亚铁与稀硝酸混合:Fe(OH)2
+ 2H+ Fe2+
+ 2H2O
 D. 铜片插入三氯化铁溶液中:Cu
+ 2Fe3+ Cu2+
+ 2Fe2+
D. 铜片插入三氯化铁溶液中:Cu
+ 2Fe3+ Cu2+
+ 2Fe2+
9.尼泊金甲酯常用作化妆品防腐剂,其结构简式为
下列关于尼泊金甲酯的叙述,错误的是 ( )
A.分子式是C8H8O3
B.分子内所有的原子可能都在同一平面上
C.和NaOH溶液反应,1mol尼泊金甲酯消耗2mol NaOH
D.尼泊金甲酯的同分异构体中,苯环直接连着羟基和羧基的有10种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com