
题目列表(包括答案和解析)
30.(18分)在自然界,当选择压高的时候,在短期中就可以形成新的品种,这种事例是存在的。金黄色葡萄球菌对青霉素的抗性就是由于青霉素的选择作用而形成的。青霉素淘汰种群中无抗性的细菌而保存了有抗性的细菌。在种群中抗性基因是本来存在的,但是频率极低。而青霉素的选择压是比较强的。青霉素把没抗性的个体全部杀死,只留下少数有抗性的个体,因此只要选择一代,抗性基因频率就大为增加,菌群对青霉素的抗性因而大增。
请根据上述原理,利用给出的实验材料用具设计实验证明金黄色葡萄球菌种群中抗青霉素基因是本来存在的。
材料用具:培养皿 琼脂培养基 灭菌绒布 含青霉素的琼脂培养基
假设:____________________________________
预期:____________________________________
方法步骤:
29.(10分)现有含等物质的量的KHSO3、NaHSO3的混合物m g与200 mL盐酸反应。假设生成的气体全部从溶液中逸出,且气体体积均以标准状况计。请以具体数值或带有字母的代数式等填写下列空白:
(1)该固体混合物中KHSO3与NaHSO3的质量比为______________。
(2)如亚硫酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为____________mol/L。
(3)如果盐酸过量,则生成SO2气体的体积为______________。
(4)如果反应后亚硫酸氢盐有剩余,盐酸不足量,要计算生成SO2气体的体积,还需知道的条件或数据是_________________________。
(5)若KHSO3和NaHSO3以任意物质的量之比混合,则m g固体混合物与足量的盐酸完全反应时生成SO2的体积范围是______________________。
28.Ⅰ.(6分) 有机物R的相对分子质量为122,在空气中燃烧只生成CO2和H2O。
(1)写出A的可能分子式___________________ __ ___________(写三种)。
(2)若有机物R为烃,则关于其结构的下列说法中正确的是 。
A.R分子中可能含有两个碳碳叁键
B.R分子中可能含有一个碳碳双键和一个碳碳叁键
C.R分子中可能含有一个环状结构和一个碳碳双键
D.R分子中可能含有一个环状结构和一个碳碳叁键
E.R分子中可能含有一个苯环
Ⅱ.(12分) 有机物A的结构简式为:
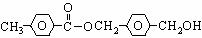
从A出发,可以发生下列图示中一系列反应,其中K的分子式为C12H14O4,L和K互为同分异构体,F的产量可作为衡量一个国家石油化工发展水平的标志。
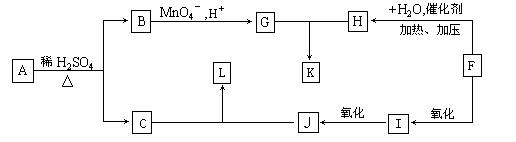
已知: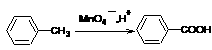
请写出:
(1)F→H的反应类型是__________。
(2)下列物质的结构简式B________________;K_______________;L________________。
(3)写出与B互为同分异构体,属于酯类且苯环上只有一个取代基的各有机物的结构简
式___________________________________________________________________________。
27.Ⅰ.(6分) 将0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为________________ ___________ _____ __。
已知:H2O(l)=H2O(g),△H= 44 kJ/mol,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是____ ______kJ。
Ⅱ.(10分) 下图表示中学化学中常见物质间的转化关系:

回答下列问题:
(1)X的电子式是_________ _______。
(2)写出化学式:A____ ________、K______ ______。
(3)写出下列反应的化学方程式
① D+F→____________________ ________________;
② G+乙醇→_____________________ _________________________。
26. Ⅰ.(4分) 有下列操作:
① 用玻璃棒蘸取待测液少许沾在湿润的pH试纸上,测定溶液的pH
② 用稀硝酸洗涤做银镜反应时附着在试管壁上的银
③ 溴乙烷试样加入稀氢氧化钠溶液煮沸,然后再加入硝酸银溶液检验其中含有溴元素
④ 在测定结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量其质量
⑤ 在某试样中加入盐酸酸化的氯化钡溶液有白色沉淀,可推论试样中肯定有SO22-
⑥ 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并放入少
量铁粉
其中设计和推理均合理的是_______ _____(填序号,多选扣分)
Ⅱ.(12分)某绿色粉末的组成可表示为Cu2(OH)2CO3·xH2O,在加热条件下,该粉末在失去结晶水的同时发生分解反应,化学方程式如下:Cu2(OH)2CO3·xH2O 2CuO + CO2↑
+ (x + 1)H2O。现取一定量该粉末(未精确测定质量)样品,用图所列仪器(夹持、加热等仪器均略)先后进行两个实验:
(Ⅰ)测定该粉末组成中结晶水的x值;
(Ⅱ)用前一个实验结束后的残留固体与乙醇蒸气反应(该残留固体可使乙醇发生去氢氧化),并检验反应产物。(已知乙醇的沸点为78℃)

(1)见图中已装配好的一套装置,回答下列问题
① 该装置用于进行实验(选填I或II) ,需加热的仪器有(选填序号字母)
② 在试管D 中所放试剂及可观察到的现象是 。
③ 为确保反应物有较高的利用率,且使装置中的气流平稳,应对C部分进行的改进是
。
(2)用图中其它仪器组装完成另一实验的装置,回答这些仪器按气流从左到右方向的连接顺序是(填写字母序号) → → →H,其中H的作用是
(3)若各装置中的反应都能进行完全,实验后测得A中固体质量减轻ag,E增重bg,C增重cg,则表示结晶水x值的计算式为(从a,b,c中选两个量计算,不必化简)
。
25.(20分)如图所示,水平面上放一长12m,质量为50kg的木板,右端有一立柱,质量为50kg的人立于木板左端,人和木板都静止。已知木板和水平面间的动摩擦因数μ=0.1,当人相对于地面以加速度为4m/s2匀加速向右奔跑,人到达木板右端时立即抱住立柱,然后人和木板一起运动。(g=10m/s2)试求:
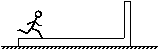 (1)人在奔跑过程中木板的加速度
(1)人在奔跑过程中木板的加速度
(2)人抱住立柱后人和木板一起运动的距离。
24. (18分)赤道上靠近地面处的地磁场可以看成水平方向的匀强磁场,现用图示的电子束演示仪粗测该处地磁场的磁感应强度.演示仪的主体是一个真空管,P是灯丝,可以产生初速度很小的电子,PQ的间距很小,PQ间的加速电压为U,MN是荧光屏,Q到MN的距离为a.实验中首先调整演示仪的方向,使加速后的电子沿地磁场的方向从电场中射出,此时电子束打在S点;再将演示仪在水平面内沿从上向下看为顺时针的方向旋转90°,结果电子打在屏上的S/点.
(1)通过分析确定s/在s的哪个方向.
(2)若测得SS/的间距为b,已知电子质量为m,电量为e,重力不计,请推导地磁场的磁感应强度大小的表达式.
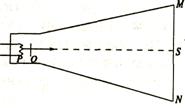
23.(16分)世界上平均海拔最高的铁路-一青藏铁路,经过数十年的论证已经开工设某国产新型列车的总质量为M,列车获得的最大牵引力为F,运行时所受的阻力约为车重的k倍
(1)如果列车要进入半径为R的弯道。该弯道处的设计速度选到多少最为适宜?(已知列车两轨间距为L,内外轨高度差为H。重力加速度为g)
(2)高原山坡较多。为保征此种列车安全行驶,青藏铁路直道上爬坡处可以设计的最大坡度角为多少?
22. (1) (6分)在测定玻璃折射率的实验中,根据测得的入射角和折射角的正弦值,画出了如图所示的图线,由图可知该玻璃的折射率n=
;当光线由玻璃射入真空中时,临界角C=
。
(1) (6分)在测定玻璃折射率的实验中,根据测得的入射角和折射角的正弦值,画出了如图所示的图线,由图可知该玻璃的折射率n=
;当光线由玻璃射入真空中时,临界角C=
。
(2)(12分)一种特殊电池,其电动势的粗略测定值约为9 V,内阻约为54Ω。已知该电池允许输出的最大电流为50mA。为了测定这个电池的电动势和内电阻,实验室备有电压表V,内阻很大,对电路的影响可以忽略;电阻箱R,阻值范围是0-9999.9Ω;保护电阻R0;开关、导线若干。
 ①实验室中备有的定值电阻尺。,有以下几种规格:
①实验室中备有的定值电阻尺。,有以下几种规格:
A.10Ω,2.5 W B.100Ω,l W
C.200Ω,l W D.2000Ω,5 W
实验时,R0应选用 (填字母代号)较好。
②在方格中画出测电池电动势和内电阻的电路图。
③写出电动势和内电阻的表达式。
21.
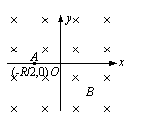 如图,空间有垂直于xOy平面的匀强磁场。t=0的时刻,一电子以速度v0经过x轴上的A点,方向沿x轴正方向。A点坐标为(-R/2,0),其中R为电子在磁场中做圆周运动的轨道半径。不计重力影响。则:①电子经过y轴时,速度大小仍为v0;②电子在
如图,空间有垂直于xOy平面的匀强磁场。t=0的时刻,一电子以速度v0经过x轴上的A点,方向沿x轴正方向。A点坐标为(-R/2,0),其中R为电子在磁场中做圆周运动的轨道半径。不计重力影响。则:①电子经过y轴时,速度大小仍为v0;②电子在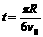 时,第一次经过y轴;③电子第一次经过y轴的坐标为(0,
时,第一次经过y轴;③电子第一次经过y轴的坐标为(0,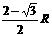 );④电子第一次经过y轴的坐标为(0,-
);④电子第一次经过y轴的坐标为(0,-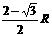 )。以上说法正确的是
)。以上说法正确的是
A.①③ B.①④ C.①②③ D.①②④
第II卷(非选择题 共174分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com