
题目列表(包括答案和解析)
2.在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓来表示的是
A.Ba(NO3)2+H2SO4=BaSO4↓+ 2HNO3 B.BaCl2+Na2SO4=BaSO4↓+2NaCl
C.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑ D.BaCl2+H2SO4=BaSO4↓+2HCl
1.下列各组中的离子,能在溶液中大量共存的是
A.H+、Ca2+、Cl-、CO32- B.Na+、Fe3+、SO42-、OH-
C.K+、Na+、Cl-、OH- D.Cu2+、Ba2+、SO42-、Cl-
25.(6分)有一表面被部分氧化的金属钠,质量为10.8g,投入到100g水中完
全反应后,收集到0.2g氢气,试计算:
(1) 被氧化的金属钠的质量是 克。
(2) 未被氧化前金属钠的质量是 克。
(3) 反应后所得溶质的质量分数为 。
22、(4分)
(1)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,请写出此步反应的离子方程式
(2)再向以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式

 23(8分)、“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察实验装置、分析实验原理,回答下列问题:
23(8分)、“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察实验装置、分析实验原理,回答下列问题:
如右图,小试管内塞有沾有无水硫酸铜粉末的棉花球.
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有_________ __、
、 。
(2)整个实验结束时,在操作上需要特别注意的问题是___________ ____。
(3)NaHCO3加热分解的化学方程式为:______________ ____。
(4)通过该实验可以得出的结论是______ __________ 、________________ 、________________ 。
24(2分)、用下列仪器的编号回答问题。
①容量瓶 ②托盘天平 ③量筒 ④烧杯
(1)加热时必须垫石棉网的有 ,
(2)使用时必须检查是否漏水的有 ,
21、(22分)A、B、C、D、E、F、G为常见物质,其中C为淡黄色固体。甲、乙、丙为常见气体。各物质的转化关系如下图所示。
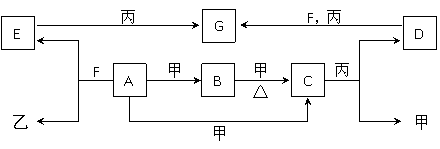

回答下列问题:
(1)C的名称是 ;F的化学式 ;A+甲→C的反应条件是 。
(2)在一定条件下,甲+乙→F,该反应属于 。(高,,考,,资,,源,,网)
①氧化还原反应 ②非氧化还原反应 ③化合反应 ④分解反应 ⑤复分解反应 ⑥置换反应 ⑦放热反应 ⑧吸热反应 ⑨离子反应
(3)写出下列变化的化学方程式。
① B+甲→C: 。
② E+丙→G: 。
 (4)少量C与足量G混合后在密闭容器中充分加热,排除气体后冷却残留的固体是
。
(4)少量C与足量G混合后在密闭容器中充分加热,排除气体后冷却残留的固体是
。
(5)化学反应都有新物质产生,同时还伴随着能量变化。我们曾观察过一个演示实验(如下图):
用脱脂棉包住约0.2gC的粉末,放在石棉网上。在脱脂棉上滴加几滴水。
请回答下列问题:(高,,考,,资,,源,,网)
① C与水发生反应的离子方程式为 ;
② 观察到的现象是 ,请解释这个现象发生的原因:
。
(6)检验G中是否含有D的试剂可以是 (填序号)。
①HCl ②BaCl2 ③Ca(OH)2 ④CaCl2
20、氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是( ) (高,,考,,资,,源,,网)
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂

 第II卷(40分)
第II卷(40分)
19.下列比较不正确的是( )
A.稳定性:Na2O﹤Na2O2 B.溶解性:NaHCO3<Na2CO3
C.碱性:LiOH﹥KOH D.还原性:K﹥Na
18.根据下列三个反应的化学方程式:I2 + SO2 + 2H2O === H2SO4 + 2HI,
2FeCl2 + Cl2 === 2FeCl3,2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 , 有关物质
的还原性依次减弱的顺序( )
A.I-、Fe2+、Cl-、SO2 B.Cl-、Fe2+、SO2、I-
C.Fe2+、I-、Cl-、SO2 D.SO2、I-、Fe2+、Cl-
17、某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数
比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )
A.1∶2 B.1∶4 C.3∶4 D.3∶2
16.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排除气体,残余物质是( )
A.NaOH和Na2O2 B.NaHCO3和Na2CO3 C.Na2CO3 D.Na2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com