
题目列表(包括答案和解析)
5、铋(Bi)在医药方面有重要应用。下列关于 Bi和
Bi和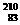 Bi的说法正确的是( )
Bi的说法正确的是( )
A. Bi和
Bi和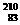 Bi互为同位素
B.
Bi互为同位素
B.  Bi和
Bi和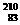 Bi都含有83个中子
Bi都含有83个中子
C. Bi和
Bi和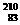 Bi的核外电子数不同 D.
Bi的核外电子数不同 D. Bi和
Bi和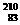 Bi分别含有126和127个质子
Bi分别含有126和127个质子
4、下列叙述正确的是 ( )
A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L
3、 人们常根据物质各种特点对物质进行分类。下列分类中,前者包含后者的是( )A.氧化物、化合物 B.溶液、分散系 C.含氧酸、酸 D.化合物、电解质
人们常根据物质各种特点对物质进行分类。下列分类中,前者包含后者的是( )A.氧化物、化合物 B.溶液、分散系 C.含氧酸、酸 D.化合物、电解质
2、2009年10月24日在京沪高速公路扬州境内高邮段发生了一起重大交通事故,是由于大雾引起的汽车追尾,雾属于下列哪种分散系 ( )
A.乳浊液 B.溶液 C.胶体 D.悬浊液
1、据2009年6月5日《扬州晚报》报道我们扬州中学1922届校友周厚复先生在1942年撰写的有关原子结构理论的论文曾被英国皇家学会推荐为诺贝尔化学奖评选论文。其胞弟在我校设立了周厚钧奖学金。已知最外层电子数相等的元素原子具有相似的化学性质。下列原子中,与氧元素原子化学性质相似的是 ( )
A.氖  B.碳
B.碳  C.镁
C.镁  D.硫
D.硫
22.(10分) 把19.2g铜加入到100mL一定浓度的浓硫酸中,加热,待铜完全溶解后,将溶液冷却至室温,再加水稀释到200mL,此时溶液中c(H2SO4)为6mol·L-1,已知铜与浓硫酸反应的化学方程式为:Cu+2H2SO4 (浓) CuSO4+ SO2↑+2H2O试求:
CuSO4+ SO2↑+2H2O试求:
(1)反应生成的二氧化硫气体在标准状况下的体积;

(2)原浓硫酸中H2SO4的物质的量浓度。
荆州中学2009-2010学年度上学期
21.(12分)某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
 材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
2NH3 + 3CuO  3Cu + N2 +3H2O
3Cu + N2 +3H2O
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应,如Cu2O(红色)会生成Cu2+和Cu:
Cu2O + 2H+ == Cu2+ + Cu +H2O
请回答下列问题:
(1)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是 。
(2)当观察到 (填现象),即表明A中的反应已经完成。
(3)该小组欲用体积比为1︰4的稀硫酸做试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1︰4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 。
可证明还原产物中含有Cu2O的操作及现是 。
(4)请写出A中生成Cu2O的化学方程式 ;
(5)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是
。
20.(8分)(Ⅰ)将25%的硫酸溶液与5%的硫酸溶液等体积混合,所得硫酸溶液的质量分数是( )
A.等于15% B.大于15% C.小于15% D.无法估算
(Ⅱ)现用98%的浓H2SO4(密度为1.84g/cm3)来配制500mL0.2mol/L的稀H2SO4。请回答下列问题:
(1) 现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③250 mL烧杯
④托盘天平 ⑤500 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,
按必需使用仪器的先后顺序排列正确的是 ( )
A.④③⑦⑤⑥; B.②⑤⑦⑥; C.①③⑤⑥⑦; D.②⑥③⑦⑤⑥
(2)经计算,需浓H2SO4的体积为 。
(3)将所配制的 稀H2SO4进行测定,发现浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母)
。
稀H2SO4进行测定,发现浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母)
。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
19. (10分)对一份白色固体,经过初步分析得知,其含有Na2CO3、Na2SO4、NaCl、CuSO4等物质中的一种或几种。甲乙两位同学为了进一步确定这份白色固体的组成便进行了如下实验:
(1)甲取了少量白色固体在试管内用水溶解,结果得无色澄清的液体。因此,甲判断肯定有一种物质不存在。这种物质的化学式是:
(2)甲依次又向那支试管内加入了稍过量的BaCl2溶液和稀硝酸,结果是先产生了白色沉淀,后又有一部分沉淀消失,且溶液里冒出了无色气泡。甲据此判断肯定有两种物质存在。这两种物质是: ,写出沉淀消失的有关的离子反应方程式:
。
(3)乙将甲实验后所得混合物进行了过滤,取滤液约2ml于另一支洁净的试管里,然后向该其中加入了稍过量的AgNO3溶液和稀硝酸,结果也产生了白色沉淀。因此乙判断那份白色固体中肯定有NaCl。你认为乙的结论:(填“对”或“不对”) ,
理由是 。
18. (10分)今欲用NaHCO3固体配制480mL 0.2mol/L的NaHCO3溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)用托盘天平称取 g固体NaHCO3。
(3)将称好的NaHCO3 固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用玻璃棒搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
(4)用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2cm时,改用 滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。
(6)配制好的溶液 (填“能”或“不能”)长期存放在容量瓶中。
(7)以下因素会造成实验结果偏低的是( )
A.定容时观察液面仰视 B.定容时观察液面俯视 C.有少量NaHCO3溶液残留在烧杯中 D.容量瓶中原来有少量蒸馏水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com