
题目列表(包括答案和解析)
24. (1)甲中的主要成分____________(填化学式); 乙中的主要成分为________(填化学式)
(2)甲中含有的主要引起胃胀气反应的离子方程式:
。
|
座位号 |
|
23. (1) 甲是_____________;离子方程式__________________________________________
(2) 甲是_____________;化学方程式__________________________________________
22. (1)____________________________________________________________________
(2) ___________________________________________________________________
21. (1)[ ]Cr2O72- + [ ]Fe2+ + [ ]H+ -[ ] Cr3+ +[ ]Fe3+ +[ ]H2O
(2)_______________________________________________________________.
28、(6分)一个体重50 kg的健康人约含铁2 g。正常人体每日需铁量为11. 5 mg。某种补铁药品标签上注明:每 100 mL 含 FeSO4 450 -460 mg 。实验室为测定这种补铁药品的含铁量,做了以下实验:
取 20.00 mL 该药品,把0.01mol/L KMnO4 溶液逐滴加入到该溶液中,当加入 12.00 mL 时,紫色不再褪去,反应的离子方程式为:
MnO4- + 5 Fe2+ + 8 H+ = Mn2+ + 5 Fe3+ + 4 H2O
问:(1)20.00 mL 溶液中含Fe2+ 的物质的量是多少?
(2)通过计算说明,测得的结果是否符合药品标签上的注明范围?
附加题(5分):
向a
L物质的量浓度为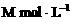 的明矾
的明矾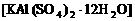 溶液中逐滴加入b L物质的量浓度为
溶液中逐滴加入b L物质的量浓度为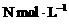 的
的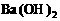 溶液时,①当b满足________时,沉淀的总物质的量为最大值;当b满足________时,沉淀的总质量为最大值。②当
溶液时,①当b满足________时,沉淀的总物质的量为最大值;当b满足________时,沉淀的总质量为最大值。②当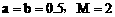 ,
,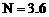 时,生成沉淀的质量为多少克?
时,生成沉淀的质量为多少克?
杭高2009学年第一学期期终考试高一化学试卷
27、(6分)将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知浓度的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硫酸,沉淀不消失反而增加0.18g。计算:
(1)原混合物中Na2CO3的质量分数。
(2)BaCl2溶液的物质的量浓度。
26、某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ-Ⅳ所示。
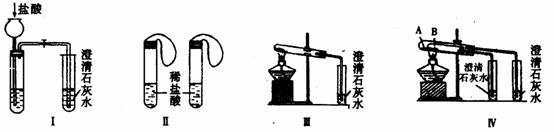
(1)图Ⅰ、Ⅱ所示实验中能够达到实验目的的是(填实验装置序号) 。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号) 。
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便 D.Ⅳ可以做到用同一套装置进行对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性。则试管B中应装入的固体最好是(填化学式) 。
(4)某同学将质量为m1 g的NaHCO3固体放在试管中加热分解一段时间后,恢复到原条件,测得剩余固体的质量为m2 g。试管中生成的Na2CO3的质量为 g。
(5)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当澄清石灰水过量时,其离子方程式为_________________。
②当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为 ,请设计实验检验所得溶液中溶质的阴离子 _______。
25、已知Cl2+H2O=HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
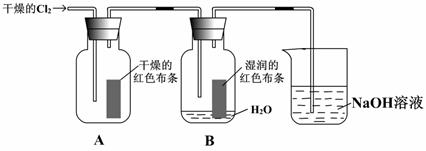
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;
从集气瓶B中湿润的红色布条的现象可得出的结论是 。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是 。
24、胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和反应,作用缓慢而持久,可维持3-4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
23、甲、乙、丙三种物质之间有如下转化关系:
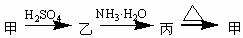
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是
。写出“乙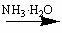 丙”转化的离子方程式:
。
丙”转化的离子方程式:
。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是: 。写出
“甲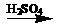 乙”转化的化学方程式:
。
乙”转化的化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com