
题目列表(包括答案和解析)
2.下列物质属于纯净物的是
A.漂白粉 B.水玻璃 C.纯碱 D.陶瓷
1.铀元素的一种核素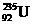 ,其中子数为
,其中子数为
A.92 B.235 C.143 D.51
28.(6分)4mg的铜与适量浓硝酸反应,铜全部溶解,共收集到NO2和NO的混合气体22.4mL(标准状况),则混合气体中NO2和NO的体积分别是多少?
27.(6分)有10.2克镁铝合金恰好溶于250mL 4mol·L-1的盐酸中,现加入2mol·L-1的氢氧化钠溶液。请回答:
(1)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是 。
(2)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是 。
26.(8分)现用Na2CO3固体配制500mL 0.200 mol•L-1的Na2CO3溶液。可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有 (填代号),还缺少的仪器是
(填仪器名称)。
(2)经计算,需Na2CO3固体质量为 。
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol•L-1。请你分析配制过程中可能引起误差偏小的原因 。
A.定容时俯视液面 B.转移时没有洗涤烧杯和玻璃棒 C.配制时容量瓶没有干燥
25.(10分)海藻中提取碘的流程如图:
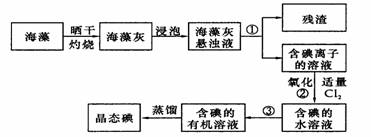
(1)指出提取碘的过程中有关实验操作名称:①__________,③_________;写出过程②中有关反应的离子方程式_____________________________
(2)在提取碘的过程中,可供选择的有机试剂有下列四组,可使用的是______ 。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、醋酸 D.汽油、甘油
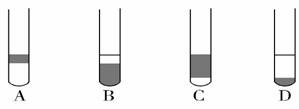
(3)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
(注:下图片中深色区为紫红色溶液)

(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持器、物品,尚缺少的玻璃仪器是_____________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图实验装置中的错误之处。
①____________ ;②_____________;③____________________。
24.(8分)现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
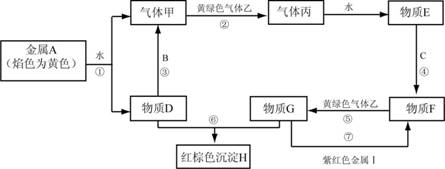
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C 、H
(2)写出反应③的离子方程式:
写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是:
实验室检验物质D中阳离子的方法是
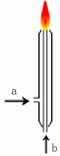
 (4)工业上按右图所示方法以甲和乙为原料制取丙。为此通入气体的合理方式是:a处通入 (填分子式),b处通入
(填分子式)。
(4)工业上按右图所示方法以甲和乙为原料制取丙。为此通入气体的合理方式是:a处通入 (填分子式),b处通入
(填分子式)。
23.(6分)下列物质:①Cl2;②Na2CO3;③NaHCO3;④K-Na合金;⑤Na。
(1)广泛用于玻璃、制皂、造纸、纺织工业的是 (填编号,下同)
(2)可用于消毒的是
(3)可用作原子反应堆的导热剂的是 。
22.(12分)标出下列反应中电子转移的方向和数目并回答问题:
3H2O2 + 2H2CrO4 = 2 Cr(OH)3 + 3O2 + 2H2O
(1)该反应中的还原剂是___________,被还原的元素________,还原产物是__________;
(2)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为_________。
21.(4分)含有一定量CH3COONa和CH3COOH的水溶液称作“缓冲溶液”,在该溶液中加入少量的强酸或强碱时,溶液的pH几乎不变,这可由下列离子方程式来说明:
加入酸时CH3COO-+H+=CH3COOH;加入碱时CH3COOH+OH-= CH3COO-+H2O,
由于CH3COOH和CH3COO-的大量存在,溶液中的c(H+)与c(OH-)基本保持不变。
一定量的H2S和NaHS的溶液也具有缓冲作用,写出在此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加入酸时 ;
加入碱时 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com