
题目列表(包括答案和解析)
3.下列变化中,必须加入氧化剂才能发生的是.( )
A. SO2→S B. Na2O2→O2 C. Fe2+ →Fe3+ D. HCO3-→CO32-
2.将一小块金属钠长期露置于空气中发生一系列变化,最终产物是 ( )
A、NaOH B、Na2O C、Na2O2 D、Na2CO3
1.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停机,雾属于下列分散系中的( )(v)
A.胶体 B.溶液 C.悬浊液 D.乳浊液
12.某同学在实验室进行甲、乙、丙、丁4组实验:各取40mL同浓度的盐酸,加入同一种镁铝合金粉末,合金质量和生成气体体积记录如下表:
|
实验序号 |
甲 |
乙 |
丙 |
丁 |
|
合金质量(g) |
0.204 |
0.306 |
0.408 |
0.510 |
|
生成气体体积(mL) (标准状况) |
224 |
336 |
448 |
448 |
请回答:
(1)盐酸的物质的量浓度为______________mol/L。
(2)乙组合金中镁的质量是_______________g。(精确到0.001)
(3)若在甲组实验后的溶液中加入浓度为0.5mol/L NaOH溶液,使产生的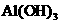 沉淀恰好溶解,则需
沉淀恰好溶解,则需 溶液的体积为______________mL。
溶液的体积为______________mL。


11.碱式碳酸铜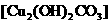 是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物。
是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物。
(1)若用下列仪器对分解产物中的非固体氧化物进行验证。
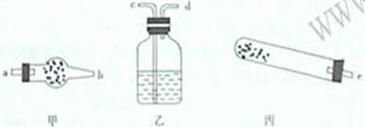
则碱式碳酸铜应该放在________中(填甲、乙、丙),且还需使用的玻璃仪器是__________________。
(2)将碱式碳酸铜与过量的木炭混合加热,可能得到铜、一氧化碳和水三种物质,该反应的化学方程式是____________________________________________________。
(3)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)。现有w g黄铜样品,放入足量的橘盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是________________(用含m、V的代数式表示)。
10.某同学设计了如下实验,以测定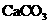 、
、 和
和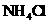 固体混合物中氮元素的质量分数。实验过程如下图所示:
固体混合物中氮元素的质量分数。实验过程如下图所示:
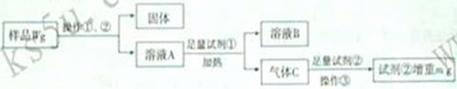
请回答:
(1)操作①和②的名称分别是_________________。
(2)原样品中氮元素的质量分数为______________(用含W、m的代数式表示)。
(3)若该同学由于操作不当而使测定结果偏低,其原因可能是___________(填字母)。
a.试剂①用量不足 b.固体未经洗涤
c.试剂②用量不足 d.气体C未经干燥
9.某过氧化钠( 样品中含有少量
样品中含有少量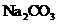 ,取一定质量的样品跟过量稀硫酸充分反应
,取一定质量的样品跟过量稀硫酸充分反应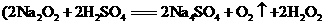 ,可通过测定产生O2的体积来计算过氧化钠的含量。请用下列装置设计一个简单实验,以测定样品中过氧化钠的含量。
,可通过测定产生O2的体积来计算过氧化钠的含量。请用下列装置设计一个简单实验,以测定样品中过氧化钠的含量。
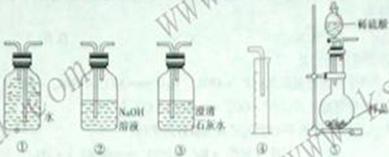
请回答:
(1)按气流从左至右的方向,各装置的连接顺序是( )→( )→(③)→( )→( )。
(2)装置②中反应的离子方程式是_______________________________________。
(3)装置③的作用是___________________________________________________。
8.今有一混合物的水溶液,只可能含有以下离子中的若干种: 、
、 、
、 、
、 、
、 、
、 、
、 ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入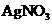 溶液有沉淀产生
溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量 溶液后,过滤干燥,得沉淀6.27g,再经足量盐酸洗涤,干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
溶液后,过滤干燥,得沉淀6.27g,再经足量盐酸洗涤,干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A. 一定存在
B.
一定存在
B. 一定存在
一定存在
C.100mL溶液中含0.01molCO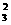 D.
D. 一定不存在,
一定不存在, 可能存在
可能存在
II卷(非选择题 共26分)
7.向50mL 18mol/L的浓硫酸溶液中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量
A.小于0.45mol B.等于0.45mol
C.在0.45和0.9mol之间 D.大于0.9mol
6.把一定量的 溶液滴入明矾
溶液滴入明矾 溶液中,使
溶液中,使 全部转化成
全部转化成 沉淀,此时铝元素的主要存在形式是
沉淀,此时铝元素的主要存在形式是
A. B.
B. C.
C. D.
D. 和
和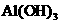
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com