
题目列表(包括答案和解析)
4、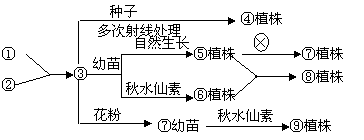 在某作物育种时,将①、②两个植株杂交,得到③,将③再作如下图所示处理。下列分析错误的是
在某作物育种时,将①、②两个植株杂交,得到③,将③再作如下图所示处理。下列分析错误的是
A、由③到④过程一定发生了非同源染色体上非等位基因的自由组合
B、由⑤×⑥的育种过程中,依据的主要原理是染色体变异
C、若③的基因型为AaBbdd,则⑩植株中能稳定遗传的个体占总数的1\4
D、由③到⑦过程可能发生突变和基因重组
3、下列关于细胞生命历程的叙述,正确的是
A、核糖体在细胞有丝分裂间期不发挥作用
B、有丝分裂后期染色单体数与DNA分子数相同
C、细胞全能性的 实现与细胞的分化无关
D、细胞衰老的过程中部分酶活化性改变
2、鼠害一直是生态学工作者关注的问题。下列有关控制老鼠种群数量的叙述,不合理的是
A、适当放养老鼠的天敌,进行生物防治
B、严密储存食物,降低环境容纳量
C、最有效的方法是,杀死老鼠将其数量降低一半
D、利用基因工程等技术降低老鼠的出生率
1、 下列关于组成细胞的物质的叙述,正确的是
A、细胞膜上所有的蛋白质都可以运输离子
B、淀粉和糖原的单体结构不完全相同
C、家兔肝细胞中的RNA可用吡罗红来检测其分布
D、核酸的特定功能取决于核苷酸的数量多少
31.(20分)1905年,E.B.Wilson发现,雌性个体有两条相同的X染色体,雄性个体有两个异型的性染色体,其中一条与雌性个体的性染色体不同,称之为Y染色体。1909年,摩尔根从他们自己培养的红眼果蝇中发现了第一个他称为“例外”的白眼晴的雄蝇。用它做了下列实验:(注:不同类型的配子及不同基因型的个体生活力均相同),
实验一:将这只白眼雄蝇和它的红眼正常姊妹杂交,结果如右下图所示:
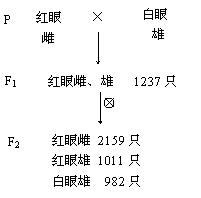 实验二:将实验一中的F1代红眼雌蝇与最初的那只白眼雄蝇作亲本进行杂交得到子一代。
实验二:将实验一中的F1代红眼雌蝇与最初的那只白眼雄蝇作亲本进行杂交得到子一代。
请分析实验,回答以下各小题:
(1)从实验一的结果中可以看出,显性性状是:
。
(2)根据实验一的结果判断,果蝇的眼色遗传是否遵循基因的分离定律? (填遵循或不遵循)。请写出判断的最主要依据。
(3)在实验一的F2中,白眼果蝇均为雄性,这是孟德尔的理论不能解解释的,请你参考E.B.Wilson的发现,提出合理的假设:
。
(4)实验二的预期结果能说明果蝇眼色的遗传与性别有关吗? 。请用遗传图解并配以简要的文字加以说明。(相关基因用A,a表示)
(5)请利用上述实验中得到的材料设计一个能验证你的假设的交配方案。
。(只写出交配方式)
30.(22分)请利用所提供的实验材料和用具设计一个实验,证明植物光合作用可以吸收CO2,呼吸作用可以放出CO2。(要求尽量在较短的时间内完成实验)
所供的实验材料、用具:锡箔纸,试管若干支,橡皮塞若干个,水浴槽一个,量筒一只,新鲜金鱼藻小枝若干,清水,指示剂溶液(中性时呈绿色,酸性时呈黄色,碱性时呈蓝色)。
实验目的:(略)
实验原理:(略)
实验步骤:
第一步:
第二步:
……
……
实验结果的预测和分析:
29.(19分)乙偶姻是一个极其重要的香料品种,主要用于配制奶香型、肉香型、草莓香型香精,也可用于合成其他精细化学品。已知乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。请回答:
(1)X是乙偶姻的同分异构体,属于酯类,X结构有____________种。
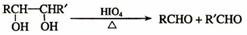 已知:
已知:
乙偶姻中含有碳氧双键,与乙偶姻有关的反应如下:
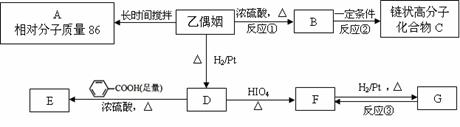
(2)写出反应①、②的反应类型:反应① ___________、反应② ___________。
(3)A的一氯代物只有一种。写出乙偶姻、C的结构简式:
乙偶姻 __________________、C_________________。
(4)写出D → E反应的化学方程式__________________________________。
(5)设计实验方案。
I.检验F中的官能团 ,
II.完成反应③的转化的实验操作
28.(8分)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2 及固体催化剂,使之反应。已知:N2(g)+3H2(g)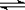 2NH3(g);△H=-92.2 kJ·mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g);△H=-92.2 kJ·mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量__________。
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1mol H2 及固体催化剂,反应达到平衡时NH3的体积分数_______________。
A.等于0.25 B.大于0.25 C.小于0.25
 (3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充
入N2的物质的量a(mol)的取值范围是______________。
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充
入N2的物质的量a(mol)的取值范围是______________。
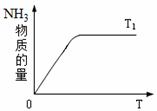
(4)右图是T1℃时容器中NH3的物质的量随时间的变化曲线, 请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的 变化曲线。
27.(19分)Ⅰ.为了预防碘缺乏病,国家规定每千克食盐中应含有40 mg~50 mg的碘酸钾。为检验某种食盐是否为合格的加碘食盐,某同学取食盐样品428 g,加水溶解。将得到的溶液用足量的稀硫酸酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色。再将该溶液用0.03 mol·L-1的硫代硫酸钠溶液滴定,当消耗18.00 mL硫代硫酸钠溶液时,溶液的蓝色刚好褪去,反应的离子方程式是I2+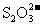 →I-+
→I-+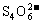 。
。
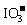 (1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的 ,配平离子方程式。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的 ,配平离子方程式。
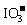 ______ +______I-+______H+=______I2+______H2O
______ +______I-+______H+=______I2+______H2O
(2)若要检验食盐中是否含有K+,实验操作是_____________________________。
(3)工业上用石墨和铁为电极电解KI溶液制取KIO3。电解时石墨电极上的电极反应式是______________________________________,
(4)该食盐样品中KIO3的含量是___________mg·kg-1。
Ⅱ.通常Fe2+、Fe3+均极易与CN-形成络离子:[Fe(CN)6]3-、[Fe(CN)6]4-,其中[Fe(CN)6]3-在中性条件下能发生水解,生成Fe(OH)3。试回答下列问题:
(5)写出HCN分子的结构式_________________________________
(6)[Fe(CN)6]3-在中性条件下水解可生成Fe(OH)3,同时还能生成的微粒有_____、_____;
(7)有一种蓝色晶体,其化学式可写作KaFeⅡbFeⅢc(CN)d(H2O)e,其中FeⅡ、FeⅢ分别代表Fe2+、Fe3+离子,晶体的理想结构特征是:
①Fe2+和Fe3+分别占据每个立方体互不相邻的顶角上;
②CN-离子以直线形排布在立方体的每条棱边的中间,(成键方式为Fe2+←C≡N→Fe3+)
③每个立方体的中心均被一个K+或者一个H2O分子占据。综上所述,试判断:
在该晶体的结构中,每个Fe2+周围结合的C原子围成的空间呈___ ___形;此晶体组成中a∶b∶c∶d∶e =_______________________
26.(14分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图的转化关系,已知C为密度最小的气体,甲非电解质。
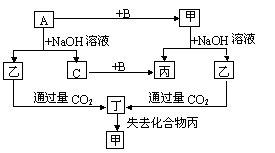 根据以上转化关系回答:
根据以上转化关系回答:
⑴写出下列物质的化学式:A: Al 、
乙: NaAlO 、丁: Al(OH) 。
⑵组成部分A的元素在周期表中的位置是:
第三周期第ⅢA族 ,
⑶写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式:
2Al+2NaOH+2HO=2NaAlO+3H↑
②乙与过量CO2反应的离子方程式: AlO-+CO+2HO=Al(OH)↓+HCO- 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com