
题目列表(包括答案和解析)
6、氨水的下列性质中,可以证明它是弱电解质的是:
A、在相同的条件下,氨水的导电性比等物质的量浓度的一元碱溶液弱
B、氨水受热分解挥发出氨气
C、0.1mol/L氨水在常温下的pH值约为11
D、常温下氨水所能达到的最大浓度不如可溶性强碱
5、向10mLpH=2的某酸溶液中加入10mLpH=12的NaOH溶液,充分反应后,滴入石蕊试液显红色,如果滴入甲基橙显黄色,则此酸一定是:
A、弱酸 B、多元弱酸 C、一元强碱 D、无法确定
4、在一定温度下,在100mL某一元弱酸HA的溶液中,含有该弱酸的分子数为5.42×1020个,并测得该溶液的[H+]=10-3mol/L,在该平衡体系中,这种一元弱酸的电离度约为:
A、9% B、10% C、3% D、0.1%
3、0.25mol/L H2SO4溶液10mL与0.5mol/L NaOH溶液10mL混合后,在加水稀释为100mL,各取少量分别加入有关指示剂,呈现颜色正确的是:
(1)甲基橙��黄色;(2)酚酞��红色;
(3)石蕊��红色;(4)酚酞��无色;
A、(1)(4) B、(1)(2)
C、(2)(3) D、(3)(4)
2、在一定温度下某酸溶液中水的电离度与某碱溶液中水的电离度相等,两溶液等体积混合后,混合液的pH:
A、大于7 B、小于7 C、等于7 D、无法确定
1、下列物质属于强电解质且能导电的是:
(1)氯化钠溶液;(2)氯化铵固体;(3)铜;(4)石墨;(5)熔融NaOH;(6)稀硫酸;(7)苯甲酸;
A、(1)(2)(5)(6) B、(5)
C、(2)(5) D、(1)(3)(4)(5)(6)
16、(1)OH-Cl-K+(2)铁粉Ag
(3)OH-、Cl-、Ag+、Fe3+KNO3
解析:(1)甲厂的废水明显呈碱性,即含大量OH-,而Ag+、Fe3+与OH-不能共存,故Ag+、Fe3+只能在乙厂废水中,由于C1-与Ag+不共存,故Cl-在甲厂中,依电荷守恒,甲厂废水中必含的阳离子只能为K+。所以甲厂废水含OH-、C1-、K+,乙厂废水中含Ag+、Fe3+、NO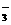 。
。
(2)加入铁粉回收银Fe+2Ag+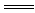 Fe2++2Ag↓
Fe2++2Ag↓
(3)混合后OH-与Fe3+、Ag+;C1-与Ag+转化为沉淀,剩下的只有KNO3。
点评:解答离子共存题,要看清题目,审准题意,挖掘出隐含条件。有的离子虽不存在于书面上的离子组中,但有时在条件中“隐含”出现,如某强酸性(或强碱性)溶液中能大量共存,说明溶液中除离子组内各离子外,还应有H+(或OH-)。此外,还要注意溶液是否有颜色。如Cu2+、Fe3+、MnO 等都有颜色,若为无色则说明其不存在。
等都有颜色,若为无色则说明其不存在。
15、(1)2H++SO +Ba2++2OH-
+Ba2++2OH-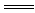 BaSO4↓+2H2O
BaSO4↓+2H2O
(2)Ba2++SO
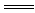 BaSO4↓
BaSO4↓
解析:因NaHSO4是二元强酸的酸式盐,可以理解成全部电离。当反应后溶液呈中性时其反应式是2NaHSO4+Ba(OH)2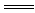 BaSO4↓+Na2SO4+2H2O,离子反应式是2H++SO
BaSO4↓+Na2SO4+2H2O,离子反应式是2H++SO +Ba2++2OH-
+Ba2++2OH-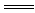 BaSO4↓+2H2O。此时中性溶液中只有Na2SO4溶液,加入B(OH)2的离子反应式为Ba2++SO
BaSO4↓+2H2O。此时中性溶液中只有Na2SO4溶液,加入B(OH)2的离子反应式为Ba2++SO
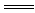 BaSO4↓。
BaSO4↓。
点评:酸式盐和碱的反应,情况比较复杂。因为由于加入碱的量不同,其产物有所不同,所以建议对此类问题先写成化学方程式再改写成离子方程式。
14、(1)K2CO3+H2SO4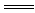 K2SO4+H2O+CO2↑
K2SO4+H2O+CO2↑
(2)AgNO3十NaCl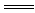 AgCl↓+NaNO3
AgCl↓+NaNO3
(3)CuSO4+2NaOH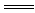 Na2SO4+Cu(OH)2↓
Na2SO4+Cu(OH)2↓
(4)SO2+2NaOH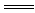 Na2SO3十H2O(或其他合理答案)
Na2SO3十H2O(或其他合理答案)
13、(1)Fe2O3+6H+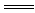 2Fe3++3H2O
2Fe3++3H2O
(2)CO +2H+
+2H+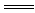 H2O十CO2↑
H2O十CO2↑
(3)Cu2++SO +Ba2++2OH-
+Ba2++2OH-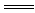 BaSO4↓+Cu(OH)2↓
BaSO4↓+Cu(OH)2↓
(4)Ca2++2OH-+CO2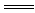 CaCO3↓+H2O
CaCO3↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com