
题目列表(包括答案和解析)
27、白色粉末A由Na2S、Na2SO3、Na2SO4和NaCl等物质中的三种混合而成。取一定量A样品,投
入100 mL 2.2 mol·L-1盐酸中,充分反应后过滤最终得到100 mL含H+的物质的量浓度为1 mol·L-1的滤液,若将此滤液蒸干,只得到8.19 g纯净物B。
(1)纯净物B的化学式为_____________________;
(2)A中是否有NaCl_____(填“有”或“没有”),理由是________________。
(3)若反应后还生成0.896 L(标准状况)气体,且该气体不会使品红褪色。求所取的A样品中含有Na2S的物质的量。
(已知2S 2-+SO +6H+ ==== 3S↓+3H2O)
+6H+ ==== 3S↓+3H2O)
26、将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
(1)当生成沉淀的质量刚好最大时,消耗CO2的体积
 为224mL(标准状况)。
为224mL(标准状况)。
①在图示坐标系中,画出生成沉淀的质量m(g)与通入
CO2的体积V(mL)的关系曲线。
②图示坐标系中,生成沉淀的最大质量是 (g);
沉淀恰好全部溶解时消耗CO2的体积为 (mL)
③原混合物中KOH的质量为 (g)。
(2)若KOH和Ca(OH)2以任意比混合,总质量仍保持1.3g不变,则消耗CO2的总体积V的取值范围为 。
25、混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(1)若向其中一包加入50mL3mol/L的Ba(OH)2溶液(过量),使CO32-、HCO3-全部变为沉淀,过滤后,再向滤液中加入50mL2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸钠与氢氧化钡的反应:
碳酸钠氢与过量氢氧化钡的反应:
②混合物A中NaHCO3的质量为 g。
(2)若向另一包中先加50mL8mol/L的HCl溶液,使CO32-、HCO3-全部变为CO2后,再加50mL2mol/L
的Ba(OH)2溶液,混合后的溶液c(OH-)=1 mol/L。(混合后溶液体积变化忽略不计)
①写出有关的离子方程式
②混合物A中Na2CO3的质量为 g
24、已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):



 产物之一
产物之一


 甲 丙
B 丙 E 水 丙
甲 丙
B 丙 E 水 丙
|





 A
D G
②
A
D G
②






 乙 丙
C 丙 ① F 水 H溶液
乙 丙
C 丙 ① F 水 H溶液
试回答:
(1)与丙互为同素异形体的单质是__________________(写化学式)
(2)从A到H八种化合物中摩尔质量相同的是___ _______(写化学式)
(3)写出①②两步的化学方程式:
①________________________________________
②___________________________________ _
23、向W g由NaHS、 、
、 组成的混合物中,加入一定量的水充分反应后过滤.已知滤液中只含有
组成的混合物中,加入一定量的水充分反应后过滤.已知滤液中只含有 ,滤渣不溶于稀盐酸,且反应过程中无气体逸出.
,滤渣不溶于稀盐酸,且反应过程中无气体逸出.
(1)滤渣的成分是____________________________;
(2)原混合物中NaHS、 、
、 的物质的量之比是_______;
的物质的量之比是_______;
(3)用离子反应方程式表示滤渣的形成过程_______________________.
22、实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)实验②中所发生反应的离子方程式为_____________________________。
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为___________________。
(4)将n mL甲溶液与等体积乙溶液按上述任意方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是____________________________________。
21、硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃-900℃时,硫铁矿在氧气中煅烧,可能发生下列反应:
3FeS2+8O2→Fe3O4+6SO2 ①
4FeS2+11O2→2Fe2O3+8SO2 ②
(1)含硫32%的硫铁矿样品(杂质不含硫),其FeS2的含量为_________。
(2)设120 kg纯净的FeS2按②式完全反应,产生标准状况下SO2_________m3。
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量氧气,当氧气过量20%时,所得炉气中SO2的体积分数为多少?
(4)480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比n(Fe)∶n(O)=4∶a,此时消耗氧气为b mol。
①试写出b与a的关系式:_____________________________。
②b的最大值为____________,最小值为_____________。
20、随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数是23,相对原子原子质量为51。回答下列问题:
(1)钒被认为是一种稀土元素,广泛存在于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为_____________。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO ,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应式并表示电子转移方向和数目:
,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应式并表示电子转移方向和数目:

其中还原剂是__________。若消耗0.9 g草酸,所对应钒元素质量是_____________ g。
19、某无色溶液中含有K+、Cl-、OH-、SO 、SO
、SO ,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。

(1)图中试剂①-⑤溶质的化学式分别是:
①________,②________,③________,④________,⑤________。
(2)图中现象a、b、c表明检验出的离子分别是:a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式是_____________________。
(4)无色溶液A加试剂③的主要目的是___________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是__________________。
(6)气体B通入试剂④发生反应的离子方程式是___________________________。
18、已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关反应式,是离子反应的只写离子方程式:
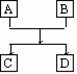 (1)若A、D的组成元素同主族:
(1)若A、D的组成元素同主族:
①B是水:__________________________________________。
②B、C均为氧化物(反应有重要的工业价值):
___________________________,工业价值是:_________________。
(2)若A、D的组成元素不同主族:
①B是水且水是还原剂:__________________________________________;
B是水且水是氧化剂(反应有重要的工业价值): 工业价值是:
②B、C均为氧化物:____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com