
题目列表(包括答案和解析)
3、下列反应中,属于吸热反应的是( )www.k@s#5¥
A、活泼金属跟水反应 B、制造水煤气
C、酸碱中和反应 D、镁条燃烧
2、下列电子式书写正确的是( )www.k@s#5¥
A、HCl H+[: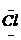 :]-
B、HClO H[:
:]-
B、HClO H[: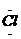 :
: :]-
:]-
C、H2O2 [H: :]2
D、Na2O2 Na+[:
:]2
D、Na2O2 Na+[: :
:  :]2-
Na+
:]2-
Na+
1、下列关于元素周期表的说法错误的是( )www.k@s#5¥
A、元素周期表是元素周期律的具体表现形式
B、是先有元素周期律,再有元素周期表的www.k@s#5¥
C、中学课本上的元素周期表是常用的一种形式,也是唯一的一种形式
D、元素周期律是指元素的性质随着原子序数的递增而呈周期性的变化的规律
21、(18分)已知A、B、C、D、E是短周期中的5中非金属元素,它们的原子序数依次增大,A元素原子形成的离子核外电子数是零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族,E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出下列元素的名称
B ;C ;E 。
(2)画出E的阴离子的结构示意图 ;
(3)A的单质和C的单质在一定条件下反应生成化合物X,该反应的化学方程式为 ;向X的水溶液中滴入酚酞,可观察到 。
(4)(6分)将9克的B单质在足量的D单质中燃烧,所得的气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是什么?其物质的量浓度分别是多大?
|
20、(8分)在400℃时,将一定量的SO2和14mol O2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2  2SO3,已知2min后,容器中剩余2mol SO2和12mol O2,则:
2SO3,已知2min后,容器中剩余2mol SO2和12mol O2,则:
(1)生成了 mol SO3,SO2的起始物质的量浓度是 。
(2)2min内平均反应速率:v(SO2)是 mol/(L·min),v(SO3)是 mol/(L·min)。
19、(12分)在下列事实中,各是什么因素影响了化学反应速率。
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸: 。
(2)黄铁矿煅烧时要粉碎成矿粒: 。
(3)熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体: 。
(4)同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢: 。
(5)同样大小的石灰石分别与0.1mol•L-1盐酸和1mol•L-1盐酸反应,速率不同: 。
(6)夏天食品容易变质,而冬天不易发生该现象: 。
18、(2分)用电子式表示氯化钠的形成过程 。
17、(12分)制冷剂是一种易被压缩、液化的气体,液化后在冷冻机的管道中循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、氨、氯甲烷等制冷剂,但它们或者有毒,或者易燃。于是,科学家根据元素及其化合物性质的递变规律来研制新的制冷剂。请同学们回答下列问题:
某些元素及其化合物的易燃性、毒性变化规律如下:
(1)(3分)氢化物的可燃性:第二周期 > > >HF。
(2)(3分)化合物的毒性:PH3>NH3;H2S H2O;CS2 CO2;CCl4 CF4。
于是,科学家们就把注意力集中在含有F、Cl的化合物上。
(3)已知CCl4的沸点是76.8℃,CF4的沸点是-128℃,新的制冷剂的沸点应该介于其间。经过经常时间的反复试验,一种新的制冷剂氟利昂-12(CCl2F2)终于诞生了,其它类似的氟利昂还可能有 。
(4)尽管这种制冷剂因为能够破坏大气中的 造成环境污染而逐渐被淘汰,但求助于元素周期表中元素及其化合物的 (从下列各项中选取)变化趋势来开发研制制冷剂的科学思维方法是应该借鉴的。
A.沸点 B.毒性 C.水溶性 D.颜色 E.易燃性
16、反应E+F=G在温度t1下进行,反应M+N=K在温度t2下进行,已知t1>t2,且E和
F的浓度均大于M和N的浓度(其他条件均相同),则两者的反应速率( )
A.前者大 B.后者大 C.相等 D.无法判断
15、已知CO2+C=2CO是吸热反应,反应速率为v1;N2+3H2=2NH3是放热反应,反应速率为v2。对于上述反应,当温度升高时v1和v2的变化情况为( )
A.同时增大 B.同时减少 C.v1增大,v2减少 D.v1减少,v2增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com