
题目列表(包括答案和解析)
29.黑色化合物A不溶于水,溶于浓盐酸或得黄色溶液B。用水稀释B则转化为蓝色溶液C。向C中加入KI溶液则有黄色沉淀D生成,再加入适量Na2S2O3溶液后,沉淀转化为白色,说明有E存在。E溶于过量Na2S2O3溶液得无色溶液F。若向B中通入SO2后加水稀释则有白色沉淀G生成。G溶于氨水后很快转为蓝色溶液,说明有H生成。请给出A、B、C、D、E、F、G、H所代表的化合物或离子。
28.氨氧化法可以制得50% 的硝酸,加脱水剂可进一步制得90%的硝酸,某工厂同时生产50%的硝酸和90%的硝酸,两种产品的质量比为:
50%的硝酸∶90%的硝酸 = m1∶m2
若以17t液氨为原料生产,并假定氨的转化率为100%。设两种产品的总质量为yt,所需水的量为xt。
⑴导出y和x之间的函数关系式。
⑵根据导出的关系式,求只生产50%的硝酸和只生产90%的硝酸所需水的量。
⑶当进出水平衡时,两种产品的总质量为多少t?
附加题:
27.某化肥厂用NH3制NH4NO3其主要反应如下:
4NH4+5O2====4NO+6H2O 2NO+O2====2NO2
3NO2+H2O====2HNO3+NO NH3+HNO3====NH4NO3
已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑生产上的损耗,其原料是循环使用)的百分含量为多少?
26.资料显示: “氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
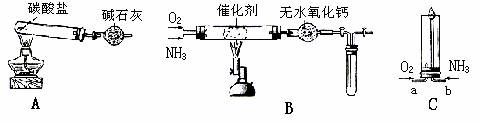
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ___;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热,氨催化氧化的化学方程式是 ______;试管内气体变为红棕色,该反应的化学方程式是 ;
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 ____。
其理由是 __。
②氨气燃烧的化学方程式是 __。
25.在密闭容器内加热NO2和N2O4混合气体,温度升高过程中,气体颜色由浅变深,其化学方程式为 ;然后又由深变浅,直至无色,其化学方程式为:
。停止加热后,随着温度的逐步下降,气体颜色又由无色逐渐变深,最后再变浅。
24.A、B、C、D、E分别为NH4Cl、(NH4)2SO4、NaCl、Na2SO4、Ba(OH)2五种溶液中的某一种,把它们两两混合:
(1)A和B混合产生白色沉淀,加热后无明显变化;
(2)B和C混合产生白色沉淀,加热后产生使湿润红色石蕊试纸变蓝的气体;
(3)B和E混合无明显变化,加热后产生使湿润红色石蕊试纸变蓝的气体。
根据以上现象,判断:
A为__________、B为__________、C为__________、D为___________、E为__________
23.(1)环境监测和法医学分析的砷检反应:
AsH3+ AgNO3+ H2O=== As2O3+ Ag↓+ HNO3
(2)黑火药爆炸时,发生的反应是: S + KNO3 + C === K2S + CO2 + N2 ,
每生成1 mol CO2转移_______mol电子。
(3)如果不小心把白磷沾到皮肤上,可用冷的硫酸铜溶液冲洗,其反应为:
P + CuSO4+ === Cu+ H3PO4+ H2SO4
(4)如果白磷和热的硫酸铜溶液反应:
P + CuSO4+ === Cu3P+ H3PO4+ H2SO4
22.实验室用下列装置通过制取氨再和氧化铜反应制得N2,同时还原CuO得金属Cu。
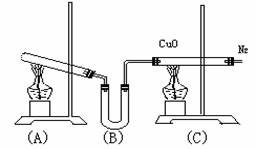
(1)写出(A)中反应的化学方程式: 。
(2)写出(C)中反应的化学方程式: ,此反应中氨表现出 性。
(3)(B)中盛装 药品,作用是 。
(4)停止反应时,应先撤离 装置中的酒精灯。
(5)从(C)装置出来的气体中可能含有 气体,若要获得较纯的N2,则应采用 收集方法为 。
21.在通常情况下,NO2和SO2很容易发生反应生成NO和SO3,该反应为不可逆反应。现将NO和SO2的混合气体通入容积为100mL的容器中,充满后用带有导管的塞子密封。
(1)向容器中通入O2的体积V(mL)在_________________数值取值范围内,才能保持容器内压强不变。
(2)要使容器内只含有NO2和SO3两种气体,则必须通入O2_______mL。
(3)若向容器中通入40mLO2后,才开始出现红棕色,且不褪色。原混合气体中NO的体积是_______mL。(气体体积均在同温同压下测定,此时SO3为气体,不考虑:
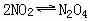 )。
)。
20.0.2 mol KMnO4在一定温度下加热生成a mol O2,将剩余的固体与浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a + b = m,则m的值可能是:
A.0.35 B.0.45 C.0.55 D.0.60
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com