
题目列表(包括答案和解析)
21、将一块镁铝合金投入足量的氢氧化钠溶液中充分反应,生成标准状况下气体3.36L,剩余固体2.3g,(不必写计算过程)
⑴反应的离子方程式为
⑵合金中铝的物质的量为
⑶合金中铝的质量分数为
9.(9分)若污水治理方案的设计合理,则在保护环境的同时,还能回收一些有价值的物质,给企业带来一定的经济效益,某工厂排出的废液中主要含有硝酸锌和硝酸银,厂方工程人员设计了如下治理方案以净化废水并回收银和硝酸锌:
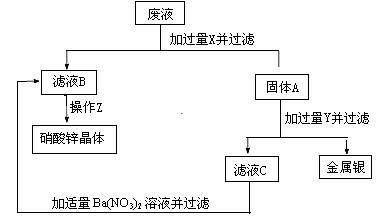
试回答:
(1)所加试剂X是:_____________,Y是_____________。
(2)下列物质的主要成分是:固体A_________,滤液B_________,滤液C__ ___。
(3)操作Z的名称是:_______________。
5.(15分)现有五种溶液:盐酸、硫酸、氢氧化钙、氯化钠、碳酸钠,请你从中选出两种溶液,用五种不同的化学方法进行鉴别。
要求:所依据的化学性质不能雷同;所用试剂在上述五种溶液之外。
①你选择的两种溶液是 。
②鉴别它们的第一种方法(包括步骤、现象、结论)是:
。
③ 鉴别它们的另外四种方法是(只要求写出所用试剂):
|
方法 |
方法2 |
方法3 |
方法4 |
方法5 |
|
试剂 |
|
|
|
|
④写出③中某个方法所发生反应的一个化学方程式。
。
3、(8分)计算下列还原反应中,氧化剂与还原剂的质量比:
①CuO+H2  Cu+H2O
, ②2H2O
Cu+H2O
, ②2H2O 2H2+O2↑ ,
2H2+O2↑ ,
③3Cl2+8NH3=6NH4Cl+N2 , ④3NO2+H2O=2HNO3+NO 。
2.(4分)在1.00L1.00mol·L-1NaOH溶液中通入16.8L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量分别为 和 。
1.(6分)某学生从一种强酸性的未知无色溶液中已检出有Ag+,他还想鉴定该溶液中是否还含有大量的Cl-、NO3-、CO32-、NH4+、Cu2+、Fe3+等,你认为其中离子 是需要鉴定的,而 离子是不需要鉴定的,其原因是
。
20.某结晶水合物化学式为R·nH2O,其式量为M。25℃时,将a g该晶体溶于b g H2O中恰好形成V ml饱和溶液。下列表示式正确的是
A、饱和溶液物质的质量为:(aM+bM-18nM) / M g
B、饱和溶液溶质的质量分数为: %
%
C、25℃时R的溶解度为: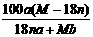 g
g
D、饱和溶液的密度为:(a-b)/ V g·mL-1
19.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是
|
选项 |
待提纯的物质 |
选用的试剂 |
操作的方法 |
|
A |
CaO(CaCO3) |
水 |
溶解、过滤、结晶 |
|
B |
Cu(CuO) |
稀盐酸 |
溶解、过滤、洗涤、干燥 |
|
C |
CuSO4(H2SO4) |
氢氧化钠溶液 |
过滤 |
|
D |
CO2(CO) |
氧气 |
点燃 |
18.根据下列实验得出的结论,正确的是
A.某固体加入稀盐酸,产生了无色气体,证明该固体一定含有CO32-
B. 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定有SO42-
C.某无色溶液滴入酚酞溶液后显红色,该溶液不一定是碱溶液
D.验证某烧碱样品中是否含有Cl-,先加入稀盐酸除去OH-,再加入AgNO3溶液,
有不溶于稀硝酸的白色沉淀出现,证明含有Cl-
17.重铬酸铵[(NH4)2Cr2O7]是一种受热易分解盐,具有很强的氧化性,下列各级对重铬酸铵受热分解产物的判断符合实际的是
A.CrO3+NO2+H2O B. Cr2O3+ NH3+H2O C. CrO3+N2 +H2O D. Cr2O3 +N2 +H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com