
题目列表(包括答案和解析)
1.北京举行的2008年奥运会提出了“科技奥运、人文奥运、绿色奥运”的口号。为了使北京奥运会办成绿色奥运会,下列做法不可取的是( )
①开始新能源,减少矿物燃料的燃烧 ②关闭所有的化工企业 ③提倡使用一次性发泡塑料餐具和塑料袋 ④开发、生产无汞电池 ⑤机动车安装尾气净化器
A.①②③ B.③④⑤ C.①④ D.②③
3.本卷考试时间为100分钟,满分为100分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Ca-40 Fe-56
第Ⅰ卷(选择题48分)
2.第I卷所有试题的答案均填入第I卷的答题卡中,第II卷答案直接写在试题处。
1.本试卷分第I卷和第II卷两部分。
22.(10分)在11-18号元素中,除稀有气体元素外(用元素符号或化学式回答):
⑴原子半径最小的元素是 ;⑵原子半径最大的元素是 ;
⑶非金属性最强的元素是 ;⑷金属性最强的元素是 ;
⑸碱性最强的最高价氧化物对应水化物是 ,它对应的氧化物的化学式为 ;
⑹酸性最强的最高价氧化物对应水化物是 ,它对应的氧化物的化学式为 ;
⑺气态氢化物中最稳定的是 ;⑻气态氢化物中最不稳定的是 。
贵州省银河中学09-10学年高一下学期3月月考
21.(10分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
⑴由这五种元素组成的一种化合物是(写化学式) 。
⑵写出C元素基态原子的电子排布式 。
⑶用轨道表示式表示D元素原子的价电子构型 。
⑷元素B与D的电负性的大小关系是 ,C与E的第一电离能的大小关系是 。(填﹥、﹤、﹦)
20.(5分)按要求写出:
⑴一核10电子的原子的核外电子排布式表示式 ;
⑵一核10电子的阳离子的原子结构示意图 ;
⑶一核10电子的阴离子的电子式 ;
⑷四核10电子的阳离子的电子式 ;
⑸五核10电子的阳离子的化学式 。
19.(16分)有A、B、C、D、E、F六种元素,已知A元素原子的最外层电子排布式为nsnnpn+1,B元素原子得到一个电子后3p轨道全充满;C、D是相邻的同主族元素,其中C元素原子的某种同位素可用于文物年代的测定;E的最外电子能层电子排布与B的最外电子能层相同,其原子只有1个d能级且已排满电子;F的核电荷数为24;
⑴A元素的最高价氧化物的水化物与它的氢化物反应所得到的化合物中所含的化学键有
;
⑵F元素的的符号为 ,与F元素同周期的所有元素的基态原子中最外层电子数与F原子最外层电子数相同的元素有 (用元素符号表示)
⑶已知G与A处于相邻主族,则由B、C、G任意两种元素形成的化合物中满足8电子稳定结构的物质的化学式为 ;
⑷写出C单质与D的氧化物发生反应的化学方程式
⑸写出E的简化电子排布式 ,已知元素B与元素E按原子个数比为1:1形成的化合物为 (填化学式),该物质与水反应是否属于氧化还原反应 (填“是或否”),原因为
18.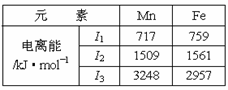 (8分)Mn、Fe均为第四周期过渡元素,两元
(8分)Mn、Fe均为第四周期过渡元素,两元
素的部分电离能数据列于右表:
⑴ Mn元素价电子层的电子排布式
为 ,
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是
;
 ⑵纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域,已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑵纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域,已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了 。
②根据A的各级电离能,估测A可能在周期表中的位置为 。
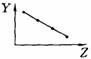
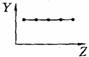
17.(5分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);

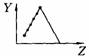
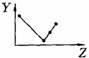
 A
B
C
D
A
B
C
D


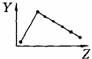

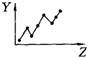
 E
F
G
H
E
F
G
H
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
⑴ⅡA族元素的价电子数( )
⑵第三周期元素的最高正化合价( )
⑶IA族元素单质熔点( )
⑷F-、Na+、Mg2+、Al3+四种离子的离子半径( )
⑸短周期元素的原子半径( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com