
题目列表(包括答案和解析)
6.在NO2与水的反应中,NO2的作用
A.是还原剂 B.是氧化剂C.既是氧化剂又是还原剂D.既不是氧化剂又不是还原剂
5.吸进人体内的O2有2%转化为氧化性极强的活性氧副产物,如· ·等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是
·等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是
A.还原剂 B.氧化剂 C.既是氧化剂,又是还原剂 D.以上均不是
4.将SO2气体通入Br2的水溶液中,发生化学反应使溶液褪色并生成了两种酸。反应中转移电子数和还原剂分别是。
A.2e-,H2SO4 B.4e-,SO2 C.2e-,Br2 D.2e-,SO2
3.SO2通常不具有的化学性质是
A.不稳定性 B.氧化性 C.还原性 D.酸性氧化物通性
2.对于下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.氨水可使酚酞试剂变为红色,说明氨溶解于水显弱碱性
1.减少酸雨产生的途径可采取下列中的哪些措施:①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
25.某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1) Z的值为 和A的值为 ;
(2)X元素在周期表中的位置 。
24.动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
|
④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
|
⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②⑤的化学方程式)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象(填A~F) |
B |
F |
|
|
|
|
② ,⑤ ,
(4)实验结论: ,
。
23.有A、B、C、D四种元素:A元素的两原子间以三对共用电子对形成气态物质,B元素原子核外有三个电子层,它是同一周期所有元素中最易失去电子的,C和B同周期,0.1mol的C与足量盐酸反应生成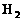 (标准状况下)3.36L,D的单质与
(标准状况下)3.36L,D的单质与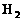 在冷暗处相遇即发生爆炸而化合。请回答:
在冷暗处相遇即发生爆炸而化合。请回答:
(1)A的气态氢化物的结构式为____________________。
(2)B的单质与水反应的离子方程式为________________________________
(3)C的最高价氧化物是_______________(离子化合物或共价化合物)
判断的依据是
与氢氧化钠溶液反应的离子方程式为________________________________ _
(4)D的单质与水反应的化学方程式
22.(11分)表1是元素周期表的一部分
表1部分元素周期表
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
D |
|
|
3 |
B |
|
C |
|
|
|
|
E |
|
4 |
|
A |
|
|
|
|
|
|
⑴ 写出元素符号: C 、E ;
⑵ D- 离子结构示意图 ,B+ 离子结构示意图 ,
⑶ 用电子表示化合物AD2的形成过程 ,
D元素氢化物电子式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com