
题目列表(包括答案和解析)
19.(10分)某课外兴趣小组欲探究铝与盐酸的反应实验中反应速率与哪些因素有关。请填写下列空白:
(1)实验反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、胶头滴管、温度计;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
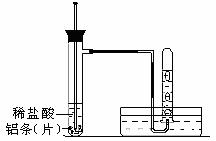 (3)实验装置 (图中铁架台等夹持仪器略去)
(3)实验装置 (图中铁架台等夹持仪器略去)
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性,具体操作方法是: 。
②取3块铝条加入到试管中,操作方法是 。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
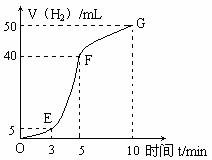 ①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG表示),并解释原因
速率大小比较: 。原因:____________________________
18.短周期元素A、B、C, 原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是 ( )
A.元素的金属性A<B<C B.A的氢化物的稳定性大于C的氢化物
C.B的最高价氧化物的对应水化物呈碱性D.A与C可形成离子化合物
第Ⅱ卷 (非选择题 共54分)
14.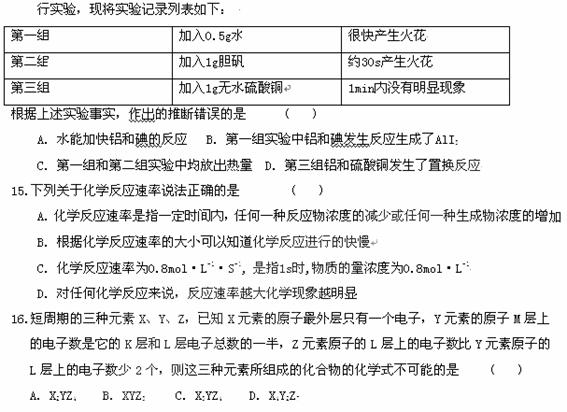 某课外小组做了一个有趣的实验,将2g铝粉和3g碘粉小心混合均匀,分成相等三份,分别进17.两种微粒的质子数和电子数均分别相等,它们不可能是 ( )
某课外小组做了一个有趣的实验,将2g铝粉和3g碘粉小心混合均匀,分成相等三份,分别进17.两种微粒的质子数和电子数均分别相等,它们不可能是 ( )
A.一种阳离子和一种阴离子 B.一种单质和一种化合物分子
C.一种分子和一种离子 D.一种原子和一种分子
13. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
|
X |
Y |
|
|
|
Z |
W |
A.原子半径: W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,Z单质的熔、沸点最高
D.W的单质能与水反应,生成一种具有漂白性的物质
12.下列分子中所有原子都满足最外层为8个电子结构的是 ( )
A.BF3 B.SiCl4 C.H2O D.PCl5
11.下列说法中,正确的是 ( )
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
10.离子键的强弱主要决定于离子半径和离子电荷值。一般规律是:离子半径越小,电荷
值越大,则离子键越强。试分析:①K2O ②CaO ③MgO 的离子键由强到弱的顺序是 ( )
A.①②③ B.③①② C.②①③ D.③②①
9.日常所用干电池其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质,电极反
应可简化为Zn – 2e- =Zn2+ ,2NH4++2e- =2NH3+H2(NH3再用于结合Zn2+)。根据上述叙述判断下列说法中正确的是 ( )
A.干电池中Zn为正极,碳为负极
B.干电池工作时,电子由Zn经外电流路向碳极
C.干电池长时间连续使用时内装糊状物可能流出腐蚀电器
D.干电池可以实现化学能向电能的转化和电能向化学能的转化
8.某一反应物的浓度是2mol· L-1,经过4min后,它的浓度变成1.68 mol· L-1,则在这4min内它的平均反应速率为 ( )
A. 0.2 mol·L-1·min-1 B. 0.1 mol·L-1·min-1
C. 0.04 mol·L-1·min-1 D. 0.08 mol·L-1·min-1
7.一定条件下,在体积为VL的密闭容器中,发生反应mA+nB=pC,t秒末,A减少了1.0mol,B减少了1.25mol,C增加了0.5mol,则m:n:P为 ( )
A.2:5:4 B.4:5:2 C.1:3:2 D.1:4:5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com