
题目列表(包括答案和解析)
4.下列广告用语在科学性上没有错误的是( )
A.这种饮料中不含任何化学物质 B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素 D.没有水就没有生命
3.下列微粒中:①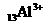 ②
②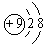 ③
③ ④
④ ,其核外电子数相同的是
,其核外电子数相同的是
A.①②③ B.②③④ C.①②④ D.①③④
2.超铀元素的发现是世界重大科技成果之一,它有力地支持了“稳定岛”假说,原子 X的中子数与电子数之差为( )
X的中子数与电子数之差为( )
A.118 B.175 C.0 D.57
1. “环境保护,以人为本”,新调整的空气质量指标中指出,影响空气质量的一组主要污染物是( )
A.SO2、NO2、可吸入颗粒物 B.CO2、N2、O2
C.CO2、O2、SO2 D.NO2、N2、可吸入颗粒物
32.(4分)A元素的最高价离子0.5 mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02 g H2,用去0.4 g A。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
(1)写出两种元素的名称:A ,B 。
(2)用电子式表示A、B形成的化合物中化学键的形成过程 。
石家庄市第一中学
31.(6分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
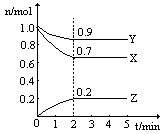 (1)该反应的化学方程式为 ;
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;Y的平均反应速率为 ;
30.(8分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
|
块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式 。
②实验结果说明催化剂作用的大小与 有关。
29.(14分)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 (10-10m) |
0.74 |
1.02 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最 低化合价 |
|
+6 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
–2 |
|
–3 |
–1 |
|
–3 |
|
回答下列问题:
(1)元素③在周期表中位置是 ; 元素④与元素⑦相比较,气态氢化物较稳定的是 (填化学式);
(2)元素①是 (写元素符号),元素⑥是 (写元素符号),二者按照原子个数比为1∶1形成的化合物与水反应的化学方程式为 ;
(3)元素⑤与元素②的非金属性强弱顺序为 (写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为 ;
(4)用电子式表示元素①氢化物的形成过程 ;写出元素⑦氢化物的电子式 ;写出实验室制元素⑤单质的化学反应方程式 。
28.(7分)(1)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应式为______,负极的电极反应式为___________,原电池的总反应是_____________;当有6.5g锌溶解时,则在标准状况下,放出的氢气的体积为 ,转移的电子数为 摩尔,溶液的酸性________(填“增强”或“减弱”)。
(2)选用下列试剂和仪器设计一个原电池。画出装置图。标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应。
试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液。
仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)
27.(2分)下列反应中,属于放热反应的是_____,属于吸热反应的是________。
A.锌粒与稀H2SO4反应制取H2 B.Ba(OH)2·8H2O与NH4Cl反应
C.氢气在氧气中燃烧生成水 D.高温煅烧石灰石使其分解
E.氢气还原氧化铜 F.葡萄糖在人体内氧化分解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com