
题目列表(包括答案和解析)
3.下列各组中,含有离子晶体、分子晶体、原子晶体各一种的是
A.KCl、 H2SO4 、S B.金刚石、NH4Cl、CH4
C.HF、 SiO2 、 Al D.金刚石、SiO2、Na2CO3
2.镭是元素周期表中第七周期第IIA族元素,关于其叙述不正确的是
A.镭的金属性比钙弱 B.单质能与水反应生成H2
C.在化合物中呈+2价 D.碳酸镭难溶于水
1.提出元素周期律并绘制了第一个元素周期表的科学家是
A. 戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿
30.(5分)某元素的同位素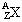 ,它的氯化物XCl2 0.95g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20ml恰好完全反应,若这种同位素原子核内有12个中子,求:
,它的氯化物XCl2 0.95g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20ml恰好完全反应,若这种同位素原子核内有12个中子,求:
(1)Z值和A值。
(2)X元素在周期表中的位置。

29.(6分)向一个容积为2L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)
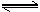
 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)以O2表示的该反应的速率;
2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3mol,计算:(1)以O2表示的该反应的速率;
(2)平衡时SO3的物质的量浓度。
28.(12分)A、B、C、D四种元素的原子序数都小于20, A与B同主族, B与C同周期, 0.2 mol的C单质与足量稀H2SO4反应时放出H2 6.72L(标准状况), A原子最外层上的电子数比次外层上的电子数多4个, C与D的原子序数之和为24.
(1)A、B、C、D的元素名称分别为:______、 ______ 、______、 _______。
(2)A的离子结构示意图为_____________, C的原子结构示意图为_____________。
(3)B原子的电子式为_____________, A与D的化合物的电子式为_____________。
(4) C的高价氧化物对应水化物跟盐酸反应的离子方程式是_________________ __;
跟烧碱溶液反应的离子方程式是______________ ______________。
27.(12分)下表是元素周期表的一部分,回答下列问题:
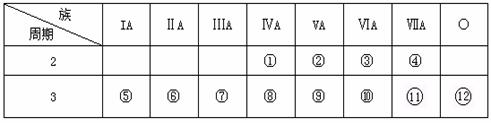
(1)在这些元素中,________(用元素符号填写,下同)是最活泼的非金属元素; ________是最不活泼的元素。
(2)这些元素的最高价氧化物的对应水化物中__________酸性最强;能形成两性氢氧化物的元素是________。
(3)从⑤到 的元素中,_______原子半径最小,写出③形成的氢化物的结构式 。
的元素中,_______原子半径最小,写出③形成的氢化物的结构式 。
(4)⑥、⑧、⑩的最高价氧化物固态时分别属于_________、__________、__________晶体。
(5)比较⑤与⑥的化学性质,_________更活泼,试用实验证明(简述简单操作、主要现象
和结论) 。
26.(11分)热化学方程式,不仅能表示反应和生成物,而且能反映化学反应过程中的的能量变化。试根据条件,回答下列问题:
(1)氢气在氧气在燃烧生成水的热化学方程式,完成下列热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH1 =-571.6 kJ·mol-1;
H2(g)+1/2O2(g)=H2O(g) ΔH2 =-241.8 kJ·mol-1
①H2(g)+1/2O2(g)=H2O(l) ΔH3 = kJ·mol-1
② H2(g)+ O2(g)= H2O(g) ΔH4=-483.6 kJ·mol-1
③2H2O(l)=2H2(g)+O2 (g) ΔH5 = kJ·mol-1
(2)ΔH1与ΔH4存在差异的原因是:
(3)由⑵可知书写热化学方程式时一定要注意:
(4)已知每千克汽油(以C7H16表示,呈液态)燃烧生成二氧化碳和液态水时约放热46 000 kJ。请写出汽油燃烧的热化学方程式 ;
等质量的氢气与汽油燃烧, 放出的热量多,氢气被公认为21世纪替代矿物燃料的理想能源,试简述氢气作为能源的三个主要优点:
①______________________________;②_______________________________;
③____________________________________。
25.(6分)现有①CaCl2 ②金刚石 ③NH4Cl ④干冰 ⑤H2SO4 ⑥碘片六种物质,按下列要求回答:(填序号)
熔化或汽化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,属于离子化合物的是___________________。
24.若短周期中的两种元素可以形成原子个数比为2:1的化合物,则这两种元素的原子序数之差不可能是 ( )
A.3 B.4 C.5 D.6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com