
题目列表(包括答案和解析)
18、(1) ①
② 、 、 、 ; 、 。
(2) , , 。
17、(1) ①( ) ②( ) ③( ) ④( ) ⑤( )
(2) ① ,② ,③ ,④ ,⑤ 。
(3) 。
23.(10分)Cu-Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),一化学研究性学习小组对其进行如下探究,请按要求完成下列探究报告。
探究目的:实验测定样品中Fe,Cu的质量。
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中Fe,Cu的质量。
实验探究:(本实验中的气体体积均已换算成标准状况)
① 将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体测得其体积为VmL。过滤得浅绿色溶液A(不含Cu2+),还有滤渣B。
② 将滤渣B投入到一定浓度的HNO3中,完全溶解,收集产生的气体,经分析气体是NO和NO2的混合气体,总体积896mL,其中NO2体积为224mL。
③ 将①中所得的滤液加入到足量的同浓度HNO3中,充分反应后再加入足量的NaOH溶液,将产生的沉淀全部滤出,充分加热灼烧得红棕色固体,称量该固体的质量为3.2g。
结果处理:
(1) A中存在的阳离子有 ,滤渣B为 。
(2) 被腐蚀前的合金中Fe的质量为 g,Cu的质量为 g。
(3) 实验探究①中V为 mL (本小题需写出计算过程,可以直接利用(2)小题计算结果) 。
前黄高级中学高一期中考试化学答题卷 2010.04.23.
第I卷(选择题)答案请填涂在答题卡上
22.(9分)某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、SO32-、NH4+、Na+。为确认溶液组成进行如下实验:
 ① 100mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.50g。若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶,同时产生能使湿润的品红试纸褪色的气体。
① 100mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.50g。若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶,同时产生能使湿润的品红试纸褪色的气体。
② 向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体0.56 L(已换算成标准状况,假定产生的气体全部逸出)。
试问答下列问题:
(1) 原溶液中,c(SO32-)= ,c(NH4+)= 。
(2) 上述实验过程中部分沉淀溶解于盐酸时反应的离子方程式为 。
(3) 根据 原理,原溶液中还有 离子存在,其浓度的范围是 。
21.(8分)已知:在常温常压下,A、B、C、D、E、F、G都是气体,其中A、G有颜色,C是相对分子质量最小的气体,B、F是空气的主要成分。各物质间转化关系如图:
|
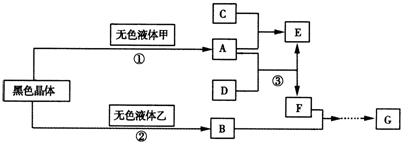
试回答下列问题:
(1) 在①、②反应中MnO2的作用分别为 ① 、② 。
(2) F的结构式为 。(3) E、D相遇时观察到的现象是 。
(4) 写出③的化学反应方程式 。
无色液体乙与SO2反应的离子方程式为 。
20.(10分) (1) 氨(NH3)是重要的含氮化合物。1774年该气体由英国普里斯特里制得。为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置。
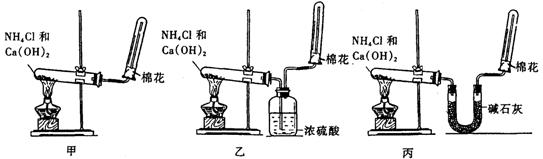
① 实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) ;
② 写出实验室制取氨气的化学方程式 。
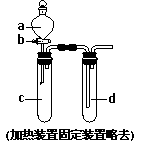 (2) 一组同学设计出右图所示装置来进行“铁与浓硫酸反应”实验,以探究化学实验的绿色化。
(2) 一组同学设计出右图所示装置来进行“铁与浓硫酸反应”实验,以探究化学实验的绿色化。
① 实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c 。其目的是 。
② 在d中加适量NaOH溶液,向c中放入过量的铁屑和一定量的浓硫酸,塞紧橡皮塞。此时铁屑表面没有气泡生成,说明铁在浓硫酸中发生了_________ ;给试管c加热,当开始有气泡产生时反应的化学方程式是 ,
d中反应的离子方程式是 。
19.(13分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
|
a |
|
|
|||||
|
|
|
|
b |
c |
d |
|
|
|
e |
|
f |
|
|
g |
|
|
(1) f元素在周期表中的位置是 周期 族。
(2) b元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,ca3的催化氧化反应的化学方程式为 ,若有1.25 mol 电子发生转移,则参加反应的ca3的体积为 L(标准状况)。
(5) a、c、d中的两种元素可组成具有10电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式 。
(6) 由a、b、c、g四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为 。
18.(10分)(1) 已知某粒子的结构示意图为: 。试回答:
① 当x-y=10时,该粒子为 (填“原子”、“阳离子”或“阴离子”)。
② 当y=8时,阳离子或阴离子可能为(填离子符号): 、 、 、 。
若它们形成化合物时离子数之比为1︰2,则这些化合物的电子式为 、 。
(2) 原子序数大于4 的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:
元素A 和B 所属周期序数之差为 ;元素A 和B 的原子序数之差为 ;元素B 和A 的最高化合价之差为 。
17.(12分) (1)下列曲线分别表示元素某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面的元素有关性质相符合的曲线的标号填入相应括号中。

① ⅡA族元素的最外层电子数( ) ② ⅦA族元素氢化物的沸点( )
③ O2-、F-、Na+、Mg2+、Al3+的离子半径( ) ④第三周期元素的最高化合价( )
⑤ 第二周期元素Be、B、C、N、O的原子半径( )
(2) 比较下列性质(用“>”、“=”、“<”填空)
 ① 氧化性 Cl2 Br2 ② 酸性 H3PO4 H2SO4 ③ 碱性
Mg(OH)2 Al(OH)3
① 氧化性 Cl2 Br2 ② 酸性 H3PO4 H2SO4 ③ 碱性
Mg(OH)2 Al(OH)3
④ 稳定性 H2S H2O ⑤ 还原性H2S HCl
(3) 元素性质呈周期性变化的决定因素是 。
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化

15.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关元素X的说法中错误的是
A.元素X能形成化学式为X(OH)3的碱
B.元素X可能形成化学式为KXO3的含氧酸钾盐
C.元素X原子的最外层电子数和核电荷数肯定为奇数
D.元素X能与某些金属元素形成化合物
 16碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
16碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口有红棕色气体出现
第II卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com