
题目列表(包括答案和解析)
33.在恒温恒容的容器中进行反应 A(g) 2B(g)+C(g),若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1,需反应的时间为( )
A.等于18s B.等于12s C.大于18s D.小于18s
34.下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是( )
A.V(H2)==0.1 mol/(L·min) B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)
D.V(N2)==0.002mol/(L·s)
35.右图是可逆反应X2 + 3Y2
2B(g)+C(g),若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1,需反应的时间为( )
A.等于18s B.等于12s C.大于18s D.小于18s
34.下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是( )
A.V(H2)==0.1 mol/(L·min) B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)
D.V(N2)==0.002mol/(L·s)
35.右图是可逆反应X2 + 3Y2 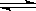 2Z2 在反应过程中的反应速率(v)与时
2Z2 在反应过程中的反应速率(v)与时 间(t)的关系曲线,下列叙述正确的是( )
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度相等
间(t)的关系曲线,下列叙述正确的是( )
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度相等
32.等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是 ( )

31.在盛有稀 H2SO4 的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
A.正极附近的 SO4 2- 离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.溶液的pH逐渐变小 D.铜片上有 H2 逸出
30.下列物质中只有离子键的是
A.Cl2 B.NaOH C.MgCl2 D.H2O
29.上个世纪80年代,科学家通过研制发现了一种新分子,其化学式是C60。有关C60的下列说法中不正确的是( )
A、C60中可能含有离子键 B、C60中的化学键只有共价键
C、C60的一个分子中有60个碳原子 D、C60是由碳元素组成的单质
27.将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率:①v(N2) = 0.15 mol/(L·min) ②v(N2) = 1.05 mol/(L·min) ③v(NH3) = 0.30 mol/(L·min)其中正确的是( ) A.①② B.②③ C.①③ D.①②③ 28.从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.酒精溶解于水 B.碘升华
C.氯化钠受热熔化 D.Cl2溶于水
25.A、B、C、D是同一短周期的四种元素,A和B的最高价氧化物对应的水化物呈碱性,且碱性前者强于后者,C和D的气态氢化物的稳定性前者强于后者,则它们的原子序数由大到小的顺序是( ) A.CDBA B.CDAB C.BADC D.BACD 26.氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( ) A.H2通入负极区 B.O2通入正极区 C.负极反应为2H2 + 4OH--4e- = 4H2O D.正极发生氧化反应
24.下列说法中正确的是( ) A.第ⅦA族元素的最高化合价都是 +7 价 B.第ⅥA族元素的最高化合价都是 +6 价 C.第ⅣA族元素的最高化合价都是 +4 价 D.第ⅠA族元素都是活泼的金属元素
22.下列各组中的两个反应,前一个反应放出的热量比后一个反应放出的热量多的是(反应物参与反应的物质的量均按方程式中的化学计量数计算)( )
① 2H2(g)+ O2(g) = 2H2O(g) 2H2(g)+ O2(g) = 2H2O(l)
② C(s)+ O2(g) = CO2(g) C(s)+ O2(g)
= CO(g)
A.只有① B.只有② C.①② D.①②都不符合题意
23.现在含有元素硒(Se) 的保健品已经开始进入市场,已知它与氧元素同族,与K同周期,关于硒的说法中不正确的是( )
A.原子序数为34
B.最高价氧化物对应水化物的分子式为H2SeO4
C.Se 的非金属性比 Br 强
D.气态氢化物的稳定性比硫化氢气体弱
O2(g)
= CO(g)
A.只有① B.只有② C.①② D.①②都不符合题意
23.现在含有元素硒(Se) 的保健品已经开始进入市场,已知它与氧元素同族,与K同周期,关于硒的说法中不正确的是( )
A.原子序数为34
B.最高价氧化物对应水化物的分子式为H2SeO4
C.Se 的非金属性比 Br 强
D.气态氢化物的稳定性比硫化氢气体弱
11.光照等物质的量混合的CH4和Cl2,产物中物质的量最多的是 A.CH3Cl B.CH2Cl2 C.CCl4 D.HCl 12.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能是 A.铝 B.铜 C.锡 D.硅 13.某元素X的气态氢化物的分子式为H2X,则X的最高正价含氧酸的分子式为( ) A.H2XO3 B.H2XO4 C.HXO3 D.HXO4 14.下列各微粒中,核外电子总数相等的是( ) A.CO2 和 NO2 B.N2 和 CO2 C.NH4+ 和 H3O+ D.H2S 和 H2O 15.在离子 RO3n- 中,共有 x 个核外电子,R 原子的质量数为 A,则 R 原子核内含有的中子数目是( ) A.A – x + n + 48 B.A – x + n + 24 C.A – x - n – 24 D.A + x - n – 24 16.最新科技报导,美国科学家发现了新的氢微粒,这种氢微粒是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考。对于这种氢微粒,下列说法错误的是( ) A.它一定含有3个中子 B.它比普通氢分子多一个氢原子核 C.它的组成可以用H3+表示 D.可以推测它的化学性质与H2不同 17. 下列关于物质性质变化的比较,不正确的是( ) A.酸性强弱:HIO4>HBrO4>HClO4 B.原子半径大小:Na>S>O C.碱性强弱:KOH>NaOH>LiOH D.稳定性强弱:HF>HCl>HI 18.在一密闭容器中充入一定量的H2和N2,经测定反应开始后0-3秒氢气的化学反应速率为0.3mol/(L•s),则3s末NH3的浓度为( ) A.0.4mol/L B.0.6mol/L C.0.9mol/L D.1.2mol/L 19.下列化学式中,具有非极性键的离子化合物是( ) A.H2O2 B.MgF2 C.NaOH D.Na2O2 20.X、Y、Z 三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序为:XH3<H2Y<HZ,下列说法中正确的是( ) A.原子序数:X>Y>Z B.非金属性:X<Y<Z C.原子半径:X<Y<Z D.离子的还原性:X3-<Y2-<Z- 21.A 和 B 是同周期的相邻元素,B 和 C 是同主族的相邻元素,且A、B、C最外层电子数之和为 19,则A、B、C三种元素按照顺序是( ) A.S、O、F B.F、O、S C.S、Cl、O D.N、F、Cl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com