
题目列表(包括答案和解析)
1.根据元素在周期表中的位置判断,下列元素中原子半径最小的是
A.氧 B.氟 C.碳 D. 氮
27.在500mL 0.2 mol·L-1的稀硝酸中加入1.92克铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液多少毫升?
26.(6分)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36 L(标准状况)的气体。

问:
(1)负极是 (填“锌”或“铜”),发生 反应(填“氧化”或“还原”)。
(2)正极的电极反应为
(3)产生这些气体共需转移电子 mol。
25. (8分)沼气是一种廉价的能源。农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭。
(8分)沼气是一种廉价的能源。农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭。
(1)已知:(C6H10O5)n+nH2O 3nCO2+3nCH4;∆H<0。请评价这个反应的实际价值与意义: 。(至少两点)
(2)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程的化学方程式:
,
并指出哪一种燃料对环境的污染小? 。
(3)8g甲烷完全燃烧生成液态水时能放出445kJ的热量,写出甲烷燃烧生成液态水时的热化学反应方程式:
(4)若建立沼气发电站,则可以实现把 转化为电能。
24.(8分)A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B,按图1装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;实验室也可用A与浓H2SO4反应制无色气体C,C气体能使品红溶液褪色。用圆底烧瓶收集干燥的C,仍按图1装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
(1)A晶体的化学式是 ,B气体的化学式
(2)图2是制取并收集气体B的部分装置,在图中方框内绘出用圆底烧瓶收集B的仪器装置简图,图中倒置漏斗的作用
(3)若用一支试管来收集B,检验B气体是否收集满的方法及现象是
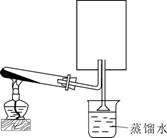

图1 图2
23.(10分)某非金属单质A经如下图所示的过程转化为含氧酸D,已知D为强酸,请回答:
(1)若A常温下为
 淡黄色固体,B是有刺激性气味的无色气体。
淡黄色固体,B是有刺激性气味的无色气体。
①写出A的原子结构示意图:
②把B通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀化学式为:
③D的浓溶液在加热的条件下可与Cu反应,该反应的化学方程式为:
(2)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式 。
②C→D的反应中氧化剂与还原剂物质的量之比为:
③写出A与H2反应产物的结构式:
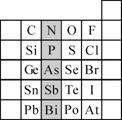
22.(10分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置为第 周期第 族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
21.(6分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
 (3)3min后图中曲线所表示的含义是
。
(3)3min后图中曲线所表示的含义是
。
20.已知 6FeSO4+2KNO3 +4H2SO4 =K2SO4+3Fe2(SO4)3+2NO↑+4H2O,下列判断正确的是
A.上述反应中KNO3是还原剂
B.反应中H2SO4是氧化剂
C.上述反应中Fe2+既体现了氧化性又体现了还原性
D.当产生0.1molNO时,则上述反应转移电子的物质的量为0.3mol
第Ⅱ卷(非选择题,共55分)
19.A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子最外层电子数:B<A
B.B与E可以形成EB2型化合物
C.A与E形成的化合物是离子化合物
D.最高价氧化物对应的水化物碱性:C<D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com