
题目列表(包括答案和解析)
29.(10分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
X |
最外层电子数是次外层电子数的3倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
第三周期元素的简单离子中半径最小 |
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是 ,元素Z的离子结构示意图为 。
(2)元素Y与氢元素可形成一种离子为 ,请写出该离子的电子式 。
(3)元素X与元素Y相比,非金属性较强的是 (用元素符号表示),
下列表述中能证明这一事实的是 。
a.Y的氢化物可在纯X2 中燃烧生成X的氢化物和Y2
b.X的单质比Y的单质更容易与H2 化合
c.X与Y形成的化合物中Y元素呈正价态
28.(12分)有A、B、C、D四种短周期元素, 它们的原子序数依次增大, 已知A和B
原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍;B元素是地壳中
含量最高的元素;C燃烧时呈现黄色火焰,且可以得到与D单质颜色相同的淡黄色
固态化合物, 试根据以上叙述回答:
 (1)元素符号: A ________ B __________ C __________ D ___________;
(1)元素符号: A ________ B __________ C __________ D ___________;
 (2)用电子式表示化合物 C2D 的形成过程 _____________________ ;
(2)用电子式表示化合物 C2D 的形成过程 _____________________ ;
 (3)写出C单质燃烧时的化学反应方程式 ______________ 。
(3)写出C单质燃烧时的化学反应方程式 ______________ 。
27. (12分)有一种溶液,其中含有Ag+、Al3+、K+、Mg2+。
(12分)有一种溶液,其中含有Ag+、Al3+、K+、Mg2+。
(1)向溶液中加入氯化钠溶液,现象为 。反应的离子方程式为 。
(2)将实验(1)所得溶液过滤,向滤液中加入过量氢氧化钠溶液,现象为 。
溶液中进行反应的离子方程式为
、 、  。
。
26.(6分)在下列物质NaCl、NaOH、Na2O2、H2O2、(NH4)2S、CCl4中:
① 其中只含有离子键的化合物是____________;
② 其中既有离子键,又有极性键的化合物是___________;
③ 其中既有离子键,又有非极性键的是_______________;
④ 其中含有非极性键的共价化合物是______________;
⑤ 其中含有极性键的共价化合物是____________;
⑥ 其中属于离子化合物的有_________________。
25. 在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO、CO、OH-等6
在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO、CO、OH-等6
种离子。已知甲烧杯的溶液显蓝色,则乙烧杯的溶液中大量存在的离子是 ( )
 A.Cu2+、H+、SO B.CO、OH-、SO
A.Cu2+、H+、SO B.CO、OH-、SO
 C.Na+、OH-、CO D.Na+、H+、SO
C.Na+、OH-、CO D.Na+、H+、SO
 第Ⅱ卷(非选择题 共50分)
第Ⅱ卷(非选择题 共50分)
24.下列关于氯的说法正确的是( )
A.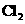 具有很强的氧化性,在化学反应中只能作氧化剂
具有很强的氧化性,在化学反应中只能作氧化剂
B.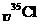 、
、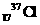 为不同的核素,它们有不同的化学性质
为不同的核素,它们有不同的化学性质
C.实验室制备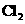 时,可用排饱和食盐水集气法收集
时,可用排饱和食盐水集气法收集
D.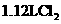 含有1.7NA个质子(NA表示阿伏加德罗常数)
含有1.7NA个质子(NA表示阿伏加德罗常数)
23. 几种短周期元素的原子半径及主要化合价见下表:
几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
K |
L |
M |
Q |
R |
T |
N |
|
原子半径/nm |
0.183 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
下列叙述正确的是( )
 A.K、L、M三种元素的金属性逐渐增加
A.K、L、M三种元素的金属性逐渐增加
 B.在RCl2分子中,各原子均满足8电子的稳定结构
B.在RCl2分子中,各原子均满足8电子的稳定结构
 C.Q元素的最高价氧化物为电解质,其水溶液能够导电
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
 D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
22.在相同条件下,将相同物质的量的Na、Mg、Al分别加入盛有同浓度、同体积盐
酸的甲、乙、丙三支试管中充分反应,生成气体体积的关系不可能是( )
 A.甲(Na) > 乙(Mg)= 丙(Al) B.甲(Na) > 乙(Mg)> 丙(Al)
A.甲(Na) > 乙(Mg)= 丙(Al) B.甲(Na) > 乙(Mg)> 丙(Al)
 C. 甲(Na) < 乙(Mg)< 丙(Al) D.甲(Na) = 乙(Mg)= 丙(Al)
C. 甲(Na) < 乙(Mg)< 丙(Al) D.甲(Na) = 乙(Mg)= 丙(Al)
21.实验中需用2.0mol/L的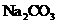 溶液921mL,配制时应选用的容量瓶的规格
溶液921mL,配制时应选用的容量瓶的规格
和称取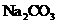 的质量分别为( )
的质量分别为( )
A.1000ml, 195.2g B.921mL,195.2g
C.100mL,21.2g D.500mL,100.7g
20.240 g 5%的硫酸镁溶液,若蒸发掉 215.4 g水以后,剩下的水刚好形成硫酸镁
晶体MgSO4·xH2O,则x值为 ( )
A.6 B.7 C.8 D.10
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com