
题目列表(包括答案和解析)
11.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( )
A.该粒子不显电性 B.该粒子质量数为4
C.与氢元素的质子数相同 D.该粒子质量比氢原子大
10.能说明A元素非金属性比B元素非金属性强的是( )
A. A原子得到电子的数目比B原子少
B. A元素的最高正价比B元素的最高正价要高
C. 气态氢化物溶于水后的酸性:A比B强
D. A单质能与B的氢化物水溶液反应,生成B单质
8.有A、B、C、D四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A的阳离子氧化性比B的氧化性弱,C的阴离子所带负电荷比D的阴离子所带负电荷多,则A、B、C、D的原子序数大小关系是( )
A.B>A>C>D B.C>B>A>D D.A>B>C>D D.B>A>D>C
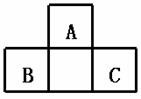 9. A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
9. A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
7.氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是( )
A. NaH在水中显酸性 B. NaH中氢离子半径与锂离子相等
C. NaH中氢离子电子排布与氦原子相同 D. NaH中氢离子可以被还原成氢气
6.下列关于物质性质变化的比较, 正确的是( ) A. 酸性强弱: HI<HBr<HCl<HF B. 原子半径大小: Na > S > O C. 碱性强弱: KOH<NaOH<LiOH D. 还原性强弱: F- > Cl- > I-
5.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )
A.R一定是第四周期元素 B.R一定是ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2R
4.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
3.已知A2-离子共含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物
质的量为( )
A.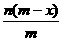 B.
B.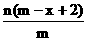 C.
C.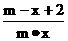 D.
D.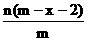
2.A原子的L层比B原子L层少3个电子,B原子核外电子总数比A原子多5个,由此AB可形成( )
A.离子化合物B2A3 B.离子化合物B3A2 C.共价化合物B3A2 D.共价化合物B2A3
1.一种比黄金贵百倍的818O2气体,不久前在兰州近代物理研究所制备成功。1mol818O2气体中所含中子的物质的量为( )
A.10mol B.18mol C.20mol D.36mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com