
题目列表(包括答案和解析)
3、下列说法不正确的是
A.化学反应中的能量变化,表现为热能、光能等
B.亿万年后地球还会生成煤、石油,因此,二者属于可再生能源
C.通过对生活垃圾的焚烧可使其中的生物质能转化热能
D.使用催化剂利用太阳能分解水是氢能产生的重要途径
2、以下说法正确的是
A.金刚石和石墨可互称为同位素 B.D2和T2可互称为同素异形体

 C.
互为同分异构体 D. H和D是同素异形体
C.
互为同分异构体 D. H和D是同素异形体
1、 下列表示物质的图或式正确的是
下列表示物质的图或式正确的是
A.氮气的电子式N┇┇N B.Mg2+的结构示意图

C.NH3的结构式
D.NaCl的电子式 
24.计算填空(11分)
(1)(4分)已知某反应的各物质浓度数据如下:



起始浓度( ): 1.5 1.0 0
): 1.5 1.0 0
2s末浓度( ): 0.9 0.8 0.4
): 0.9 0.8 0.4
则①a= ,b 。
②2S内B的反应速率= 。
(2)(4分)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有 个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
(3)(3分)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是 (用含m的代数式表示).
2009-2010学年下学期“9+4”联合体期中联考
23.(11分)短周期元素X、Y、Z可组成化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3。已知三种元素原子的质子总数为25,且Y是短周期中原子半径最大的元素,Z原子的最外层电子数是次外层电子数的2倍。试回答:
(1)X、Y元素的名称:X ; Y 。
(2)元素X的一种核素有10个中子,该核素可表示为________________。
(3)Y2X对应水化物的电子式 , ZX2的电子式为 。
(4)写出Y2X溶于水的溶液与ZX2反应生成化合物Y2ZX3的离子方程式____________。
(5)一定量的Y2X2与ZX2反应后得到固体物质A,A恰好与含0.8molHCl的稀盐酸完全反应并收集到0.25mol气体,则用物质的量表示A的组成为: 。
22.(9分)某学生对混合物A进行了如下实验:

回答下列问题:
(1)该同学的实验目的是 ;
(2)上图括号内的操作步骤均为 ;该操作用到的仪器有: .
(3)试剂a应选用下列试剂中 :
A. Na2SO4溶液 B.Na2CO3溶液 C.H2SO4溶液 D. K2CO3溶液
判断试剂a已加入过量的方法是 .
(4)试剂b的名称是 .
21.(12分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置第 周期,第 族;
(2)E元素形成的氧化物对应的水化物的化学式为 ;
(3)元素C、D、E形成的离子半径大小关系是 > > (用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程 。
C、D还可形成化合物D2C2,D2C2含有的化学键是 。
(5)由A、B、C三种元素形成的离子化合物的化学式为 ,它与强碱溶液反应的离子方程式是 。
(6)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为(化学式用具体的元素符号表示): 。
20.(11分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)570 kJ
(3)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2气体和H2O(l)放出的热量为 kJ。
 (4)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:A、B两个电极均由多孔的碳块组成。
(4)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:A、B两个电极均由多孔的碳块组成。
该电池的正极反应式为: 。
若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为 。
(5)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反
应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,
则该电池的负极反应式为: 。
19.(9分)物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
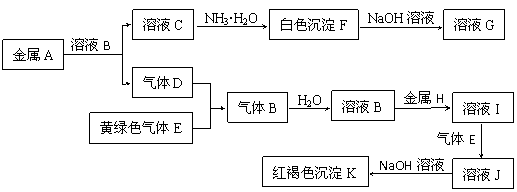

(1)A元素的原子结构示意图为 .
(2)写出下列物质的化学式:E是 ,K是 .
(3)化合物B属于 化合物(填“离子”或“共价”).
(4)实验室检验J中所含的金属离子时,常在J的溶液中加入 溶液。
(5)写出反应“F→G”的化学方程式: ;
(6)写出反应“I→J”的离子方程式: 。
18.由质量均为100 g的铁片﹑铜片和足量的CuSO4溶液组成原电池装置,经过一段时间后,两电极的质量差变为12g,则下列说法正确的是 ( )
A.铁片溶解了12 g B.导线中通过了0.2mol电子
C.铜片上析出了6 gCu D.铜片溶解了6.4g
第II卷(共63分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com