
题目列表(包括答案和解析)
0.1 mol·(L·min)-1,计算:
(1)2min末时Y的浓度。 (2)化学方程式中n的值。 (3)求反应前后压强之比。
23、(9分)把0.6 molX气体和0.6molY气体混合于2L密闭容器中,使他们发生如下反应:
2X(g)+Y(g) 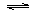 nZ(g)+2W(g)。2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为
nZ(g)+2W(g)。2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为
22、(8分)氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g) ===2H2O(l) ΔH=-572kJ/mol
 请回答下列问题:
请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)572 kJ。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为 ,当正极消耗5.6L(标准状况)气体时,外电路转移的电子数为 。
21、(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4
 甲同学研究的实验报告如下表:
甲同学研究的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2mol/L的硫酸于试管中 ② |
反应速率镁>铁,铜不反应 |
金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为 ;
(2)甲同学的实验目的是 ;
要得出正确的实验结论,还需要控制的实验条件是: ;
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是 ;
(4)乙同学完成该实验的应选用的实验药品 ;
该实验中不选用某浓度的硫酸,理由是 。
20、(8分)⑴北京奥运会“祥云”火炬用的是环保型气体燃料-丙烷(C3H8),已知0.1 mol丙烷完全燃烧生成CO2气体和液态水放出的热量为222.15 kJ,则丙烷燃烧的热化学方程式为 。
⑵在生物质能利用过程中,可将含糖类、淀粉[(C6H10O5)n]较多的农作物为原料在催化剂作用下,经水解和细菌发酵可以制得酒精(C2H5OH),它和汽油混合作为汽车的燃料。写出由淀粉制酒精的两步主要反应的化学方程式: 、 。
19、(11分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是 ;Y元素的名称是 ;Z元素的名称是 。
(2)YZ4化合物的结构式是 ,电子式是 。Y的最高价氧化物的电子式为__________。
(3) 写出Y的最高价氧化物与X的氢化物的水化物反应的离子方程式 。
|
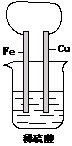 (1)铁片上的现象是 ,电极反应式
。
(1)铁片上的现象是 ,电极反应式
。
(2)铜片上的现象是 ,电极反应式 。
(3)写出该电池总反应的离子方程式 。
(4) Fe2+ 向 (填具体电极)移动,溶液中的pH (填“变大”或“变小”)。

18、(6分)某温度时,在一个2L的密闭容器中,X、Y、Z三
种物质的物质的量随时间的变化曲线如图所示。根据图中数据,
试填写下列空白:
(1)该反应的化学方程式为 .
(2)反应开始至2min,气体Z的平均反应速率为 。
16、可逆反应2NO2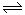 2NO+O2 在体积不变的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n
mol O2 的同时生成2n
molNO ②单位时间内生成n
mol O2 的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
2NO+O2 在体积不变的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n
mol O2 的同时生成2n
molNO ②单位时间内生成n
mol O2 的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
A.①④ B.②④ C.①③④ D.①②③④⑤
第Ⅱ卷(非选择题 共66分)
15、实验室用铁片与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是
A.加入硫酸钾溶液 B.加入几滴硫酸铜溶液
C.改用热的2mol/L硫酸溶液 D.改用浓硫酸溶液
14、短周期中三元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是
|
|
|
a |
|
|
b |
|
|
c |
|
|
A.a是一种活泼的非金属元素
B.c的最高价氧化物的水化物是一种弱酸
C.b的氢化物很稳定
D.b元素的最高化合物为+7价。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com