
题目列表(包括答案和解析)
3. 下列表示物质结构的化学用语或模型正确的是
A.HClO分子的结构式:H-Cl-O B.Cl-的结构示意图:
 C.NaCl的电子式:
C.NaCl的电子式: D.乙醇分子的比例模型:
D.乙醇分子的比例模型:
2. 科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”, 也有人称之为“零号元素”;第二种是由四个氮原子构成的分子。下列有关这两种粒子的 说法不正确的是
A.“四中子” 粒子的电荷数为0,不显电性
B.“四中子”的质量数为4,其质量比氢原子大
C.相同质量的N2和N4所含原子个数比为1∶2
 D.第二种粒子的化学式为N4,与N2互为同素异形体
D.第二种粒子的化学式为N4,与N2互为同素异形体
1. 今年的4月22日是第41届世界地球日,我国的主题是“珍惜地球资源,转变发展方式,倡导低碳生活”。下列做法符合低碳生活要求的是:①大力进行植树造林;②以煤等燃料为主要生活燃料;③鼓励私人购买和使用小汽车以代替公交车;④利用太阳能、风能和氢能等新能源代替化石燃料;⑤禁止电动自行车上路
A.①③④ B.①④ C.②⑤ D.②③⑤
27. (10分)在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
(10分)在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
(1)写出该反应的化学方程式为_______________________。
(2)比较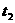 时刻,正逆反应速率大小V正
V逆。
时刻,正逆反应速率大小V正
V逆。
(3)若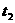 =2min,计算反应开始至
=2min,计算反应开始至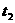 时刻,M的平均
时刻,M的平均
化学反应速率为:_________________________________。
(4) 时刻化学反应达到平衡时反应物的转化率为
。
时刻化学反应达到平衡时反应物的转化率为
。
(5) 时刻化学反应达到平衡,请写出两个可以提高此时该反应化学反应速率的方法_________
。
时刻化学反应达到平衡,请写出两个可以提高此时该反应化学反应速率的方法_________
。
25.(6分)海洋中蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
① ②
② ③
③ ……
……
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属于 键(填“极性”或“非极性”)。
(2)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
①卤素单质与氢气化合按 、
、 、
、 、
、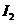 的顺序由难变易
的顺序由难变易
②卤素单质的氧化性按按 、
、 、
、 、
、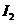 的顺序依次增强
的顺序依次增强
③卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次减弱
 ④卤化氢的还原性按HF、HCl、HBr、HI的顺序依次增强
④卤化氢的还原性按HF、HCl、HBr、HI的顺序依次增强
(3)键能是指破坏1mol共价健所需要的能量,键长是指成键原子核之间的距离。已知,卤素单质的键能大小如右图。由图推断:
①非金属性强的卤素,其单质分子的化学键 断裂
(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为: 。
 26.(7分) 利用实验室中或生活中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
26.(7分) 利用实验室中或生活中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极(铁钉、铜钉)、
(填写电解质溶液)、 (填写所缺的实验用品)、
耳机(或者电流计)
(3)实验装置
(4)原电池设计及注意的问题
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为 ,在耳机中又由 转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该为原电池 极,电极反应式是: ;若一段时间内有3.01×1023个电子发生转移,则理论上生成标准状况下气体 L。
24.(8分)下表是元素周期表的一部分,请回答有关问题:

|
(1)表中化学性质最不活泼的元素是 。(用元素符号或化学式表示,下同)
(2)表中能形成两性氧化物的元素是 ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 。
(3)④元素与⑦元素形成化合物的电子式是 。
③⑥⑦三种元素原子半径由小到大的顺序是 。
(4)③元素与⑩元素两者核电荷数之差是 。
(5)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
|
实验步骤 |
实验现象与结论 |
|
|
|
23.氢气是21世纪极有前途的新型能源。氢能开发的首要问题是研究如何以水为原料制取氢气。 以下研究方向中你认为最可行的是
A. 大量建设水电站,用电力分解水制取氢气
B. 设法将太阳能聚集,产生高温,使水分解产生氢气
C. 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气
D. 寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
22.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解质溶液。电池总反应为: Zn + 2 MnO2十H2O == ZnO + 2MnO (OH)。下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.l mol Zn 完全溶解时,流经电解质溶液的电子个数为 1.204×l023
D.电池正极反应式为: 2MnO2 + 2e -+2H2O ==2MnO (OH)+2OH-
21.把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为
A. A>B>C>D B. A>C>B>D C. A>C>D>B D. B>D>C>A
20.一定温度下,可逆反应3X(g)+Y(g)  2Z(g)达到限度的标志是
2Z(g)达到限度的标志是
A. X、Y、Z的浓度相等
B. X的生成速率与Z的生成速率相等
C. X、Y、Z的分子个数比为3:1:2
D. 单位时间内生成3n mol X,同时消耗n mol Y
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com