
题目列表(包括答案和解析)
2. 下列化学用语正确的是
下列化学用语正确的是
A.一CH3(甲基)的电子式为 B.乙炔的结构简式CHCH
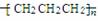 C.丁烷的最简式:C2H5
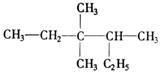
D.聚丙烯的结构简式:
C.丁烷的最简式:C2H5
D.聚丙烯的结构简式:
1.通常用来衡量一个国家石油化工发展水平的标志是
A.石油的产量 B.乙烯的产量 C.塑料的产量 D.合成纤维的产量
27.(11分)用右图装置能达到粗铜精炼的目的。
 ⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
⑴A烧杯是________________(填〝电解池〞或〝原电池〞),
B烧杯是________________(填〝电解池〞或〝原电池〞)。
⑵其中B烧杯中应该盛____ _____溶液。
⑶ 分别写出石墨棒和纯铜棒的电极反应式
石墨棒: ,
纯铜棒: 。
⑷若锌减少了0.65 g,则纯Cu的质量增加了多少克?(写出计算过程)
洪泽中学2009-2010学年度高一年级第二学期期中考试
26.(13分)有效地利用现有新能源和开发新能源已受到各国的重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能。例如,在汽油中加入乙醇来生产“无铅汽油”。乙醇的分子式为C2H6O,试根据C、H、O成键的特点,写出C2H6O所有可能的结构式或结构简式 。
(2)天然气的主要的成分是甲烷,其燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一。能说明甲烷是正四面体而非正方形平面结构的理由是 。(填写编号,多选倒扣分)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
③其三氯取代物不存在同分异构体 ④其四氯取代物不存在同分异构体
(3)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。已知4g甲烷完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,则甲烷燃烧的热化学方程式为 ;
(4)氢能是人类未来的理想能源。1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可供开发又消耗较低经济的制氢方法是 (填写编号,多选倒扣分)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后,还需要解决的问题是 。(写出其中的一个)
25.(12分)有关元素A、B、C、D、E、F的信息如下:
|
元 素 |
有关信息 |
|
A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
|
B |
最外层电子数是次外层电子数的2倍 |
|
C |
M层上有3个电子 |
|
D |
短周期原子半径最大的主族元素 |
|
E |
最高正价与最低负价代数和为6 |
请回答下列问题:
 (1)写出物质甲与乙反应的离子方程式
(1)写出物质甲与乙反应的离子方程式
(2)下列说法不正确的是 (填序号)。
① 实验室可用右图所示装置制取B的最高价氧化物
② 用C单质做成的槽车,可用来运输甲的浓溶液
③ C和铜与稀硫酸组成的原电池,C电极被还原
(3)若用石墨做电极电解元素D、E组成的化合物饱和水溶液,写出电解反应的离子方程式为:
 (4) 已知:2AO2(g)
(4) 已知:2AO2(g)  A2O4(g);△H<0。在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2O4(g);△H<0。在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
①该反应是由 开始反应的。(填“正反应”、“逆反应”、或“正逆反应同时”。)
②a、b两个点中,表示化学反应处于平衡状态的点是 。
③前10 min内用AO2表示的化学反应速率v(AO2)= mol·L-1·min-1。
24.(5分)硫代硫酸钠溶液与稀硫酸的反应方程式为:
Na2S2O3+H2SO4==Na2SO4+S↓+SO2+H2O,
某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。

甲 乙
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
|
实验 组号 |
温度 |
Na2S2O3溶液 |
H2SO4 |
加入H2O的体积 |
出现沉淀所需时间 |
||
|
体积 |
浓度 |
体积 |
浓度 |
||||
|
Ⅰ |
0℃ |
5mL |
0.1mol·L-1 |
10mL |
0.1mol·L-1 |
5mL |
8s |
|
Ⅱ |
0℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
12s |
|
Ⅲ |
30℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
4s |
结论1:由Ⅰ和Ⅱ两组数据可知 ;
结论2:由Ⅱ和Ⅲ两组数据可知 。
23.(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
1 |
① |
|
|
|||||
|
2 |
|
|
|
② |
③ |
④ |
⑤ |
|
|
3 |
⑥ |
|
⑦ |
⑧ |
⑨ |
⑩ |
|
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)⑨、⑩的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑥中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中④、⑩两种元素形成的氢化物中沸点高的是 ,说明原因:
22.燃烧2 mol某有机物,可以收集到标准状况下89.6 L的CO2和6 mol的H2O,试推断该有机物的分子式可能是
A.C2H4 B.C2H6O C.C2H6 D.C3H6O
第二卷(非选择题,共49分)
21.下列说法中错误的是
①化学性质相似的有机物一定是同系物
②分子组成相差一个或几个CH2原子团的有机物一定是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
A.①②③ B.②③ C.③④ D.①②③④
20.将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:
 2SO2(g)+
O2(g) 2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是
2SO2(g)+
O2(g) 2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是
A.每生成2mol SO2的同时,消耗2mol SO3 B.混合气体的质量不再变化
C.每生成2mol SO3的同时,消耗2mol SO3 D.每生成2mol SO3的同时,消耗1mol O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com