
题目列表(包括答案和解析)
2、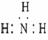
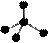 下列各项中表达正确的是
下列各项中表达正确的是
A.NH3分子的电子式: B.CH4分子的比例模型
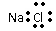 C.H2O的结构式: H-O-H
D.氯化钠的电子式:
C.H2O的结构式: H-O-H
D.氯化钠的电子式:
1、2010年上海世博会主题是“城市,让生活更美好”,下列有关世博会说法错误的是
A.世博会中国馆--“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成。由于铝的表面有一层致密的氧化膜,能够有效地防止铝的腐蚀
B.低碳经济是以低能耗、低污染、低排放为基础的经济模式,上海世博会的亮点之一是实现“二氧化碳零排放”。人们已使用乙醇汽油作为汽车燃料可真正实现“二氧化碳零排放”
C.世博会期间将用可降解的“玉米塑料”替代一次性饭盒、并可被用来制作世博会证件及胸卡,目的是为了防止产生塑料带来的白色污染
D.在整个世博园区,世博中心、中国馆、主题馆等都应用到太阳能发电技术,太阳能发电是将太阳能转化为电能
25、(6分)把0.8 mol X 气体和0.4 mol Y 气体混合于2 L 密闭容器中,使它们发生如下反应:2 X(g)+ Y (g)  n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度
(3)化学反应方程式中n 值是多少?
江苏省东台中学2009-2010年第二学期期中考试
24、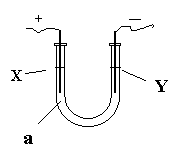 (6分)电解原理在化学工业中有广泛应用。如图所示,在U形管中加入NaCl溶液,在两极各滴入几滴石蕊试液,插入惰性电极,接通电源。
(6分)电解原理在化学工业中有广泛应用。如图所示,在U形管中加入NaCl溶液,在两极各滴入几滴石蕊试液,插入惰性电极,接通电源。
(1)①一段时间后可观察到的Y电极附近观察到的现象是 。
② X电极上的电极反应式为 ,
③请写出电解饱和NaCl溶液的化学方程式 。
(2)如果电解液a选用CuCl2溶液,则在电解过程中被氧化的是:
在此变化过程中发生的能量转化的形式是
23、(7分)为了用实验的方法验证镁和铁的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铁与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铁与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案
(2)学生乙在实验中取了一段镁条,投入稀盐酸中,现象不是十分明显,请分析原因 。
(3)学生丙另辟蹊径,仅用镁条、铁片与盐酸只进行一次实验也得出正确的结论(其它用品自选),简述学生丙用的是什么方法? 简述现象: 。
22、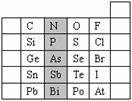 (7分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
(7分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
(1)阴影部分元素N的最高价氧化物为 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,
(3)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度 (选填“更大”、“更小”或“相同”)。
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式
21、(8分)A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧的产物可使品红溶液褪色。F和C元素形成的化合物F3C4具有磁性。A的单质在C2中燃烧可生成AC和AC2两种气体。D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)B的单质分子的结构式为 ;DC的化学式为____________;
A元素在周期表中的位置是_____________。
(2)A元素形成的同素异形体的晶体类型可能是(填序号)__________。
①离子晶体 ②原子晶体 ③金属晶体 ④分子晶体
(3) A、B、C形成的10电子氢化物中,A、B、C的氢化物沸点最高的是(写化学式)____________;B、C的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明___________________________________________。
20、(6分)在一定温度下,在1L容器中m molSO2和n mol O2,反应达到平衡时有q molSO2发生了反应,试填写下列空白:
(1)达到平衡时,c(SO2)=
(2)平衡时气体总的物质的量为
 (3)在其它条件不变时,压缩容器使压强增大该反应的速率会
;或者减少SO2的量反应速率会
。
(3)在其它条件不变时,压缩容器使压强增大该反应的速率会
;或者减少SO2的量反应速率会
。
19、(6分)(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是____________。
(2)某分子中有5个原子核,共有10个电子,这种分子的结构式是______________。
(3) CaCl2是离子化合物,其电子式为:____________________。
18、下列叙述正确的是
A.离子化合物中不可能含有共价键
B.电解氯化铜溶液时,阴极电极反应式是2Cl--2e-=Cl2↑
C.由非金属元素组成的化合物不一定是共价化合物
D.熔融NaCl、MgO晶体时克服的作用力不同
第Ⅱ卷(非选择题 共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com