
题目列表(包括答案和解析)
18、在密闭容器内,可逆反应: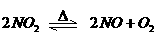 ,达到平衡状态的标志是:
,达到平衡状态的标志是:
(1)单位时间内生成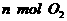 的同时生成
的同时生成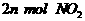
(2)单位时间内生成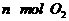 的同时生成
的同时生成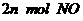
(3)用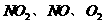 的物质的量浓度变化表示反应速率的比为2:2:1的状态
的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A.(1)(3)(4) 高*考*资*源*网 B. (2)(3)(5)
C.(1)(4)(5) D. (1)(2)(3)(4)(5)
第Ⅱ卷 (非选择题,共46分)
17、 在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8
mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8
mol·L-1,则在这10min内NH3的平均反应速率是:
在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8
mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8
mol·L-1,则在这10min内NH3的平均反应速率是:

 A.
0.1mol.L-1.min-1
高*考*资*源*网 B. 0.2mol.L-1.min-1
A.
0.1mol.L-1.min-1
高*考*资*源*网 B. 0.2mol.L-1.min-1
C. 0.3mol.L-1.min-1 D. 0.6mol.L-1.min-1
16、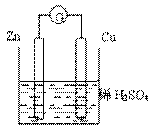 关于如图所示的装置的叙述,正确的是:
关于如图所示的装置的叙述,正确的是:
A. 电流从锌片经导线流向铜片
B. 一段时间后,电解质溶液中的硫酸根浓度减少
C. 铜是正极,铜片上有气泡产生,锌片质量减少
D. 一段时间后,电解质溶液的酸碱性保持不变
15、273K时,反应N2(g)+3H2(g)
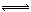 2NH3(g)
生成2 molNH3(g)时放出92.2kJ的热量。在该温度下,向一固定容积的密闭容器内通入1mol
N2和3mol H2,达到平衡时,放出热量为Q1;向另一容积相同的密闭容器中通入0.5mol
N2和1.5mol H2,达到平衡时放出热量为Q2。则下列判断不正确的是:
2NH3(g)
生成2 molNH3(g)时放出92.2kJ的热量。在该温度下,向一固定容积的密闭容器内通入1mol
N2和3mol H2,达到平衡时,放出热量为Q1;向另一容积相同的密闭容器中通入0.5mol
N2和1.5mol H2,达到平衡时放出热量为Q2。则下列判断不正确的是:
A.同时进行时,用N2表示的反应速率:情况1>情况2
 平衡时,情况1:Q1=
92.2kJ
平衡时,情况1:Q1=
92.2kJ
C.达到平衡时,混合气体的密度:情况1>情况2
D.平衡时,情况2:Q2<46.1kJ
14、下列物质中含有自由移动氯离子的是
A.氯酸钾
高*考*资*源*网  液态氯化氢 C.熔融的氯化钾 D.液氯
液态氯化氢 C.熔融的氯化钾 D.液氯
13、下列关于元素周期表的叙述,正确的是:
A.ⅡA族中无非金属元素 高*考*资*源*网 B.Ⅷ族中所含元素种类最多
C.元素周期表中18个纵行对应18个族
D.零族的所有元素均满足最外层电子数为8
12、根据元素周期表和元素周期律,下列推断中正确的是
A.溴化氢比氯化氢稳定,HClO4酸性强于HBrO4
 在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素
在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素
C.铷的硫酸盐易溶解于水,其氢氧化物一定是弱碱
D.砹是一种有色固体,它的气态氢化物很不稳定,
11、下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是:

 ① 微粒半径:S2->Cl->Ca2+>K+ ②氢化物稳定性:HF>HCl>H2S>H2Se
① 微粒半径:S2->Cl->Ca2+>K+ ②氢化物稳定性:HF>HCl>H2S>H2Se
 ③ 还原性:S2->Cl->Br->I-
④ 氧化性:Cl2>S>Se>Te
③ 还原性:S2->Cl->Br->I-
④ 氧化性:Cl2>S>Se>Te
⑤ 酸性:H2SO4>HClO4>H2SeO4 ⑥得电子能力:F>Cl>Br>I
A.②④⑥  ①③④
C.只有① D.只有⑥
①③④
C.只有① D.只有⑥
10、硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。下列对于反应 2SO2+O2
2SO2+O2 2SO3的说法中正确的是:
2SO3的说法中正确的是:
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
 该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
9、下列叙述中,甲金属一定比乙金属活泼性强的是:
A.甲原子电子层数比乙原子的电子层数多
 在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com