
题目列表(包括答案和解析)
4.下列有关原子结构和元素周期律表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
3.既能与酸反应又能与碱反应生成盐和水的氧化物是
A.Fe2O3 B、CO2 C、Al2O3 D、Al(OH)3
2.在一定温度下,可逆反应x(g)+3Y(g)⇌2Z(g)达到限度的标志是
A.Z的生成速率和Z的分解速率相等
B.单位时间内生成n mol X,同时生成3nmol Y
C.X、Y、Z的浓度相等
D.X、Y、Z的分子个数之比为1:3:2
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于
未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
20.(15分)I、(11分)短周期元素的单质X、Y、Z在通常状况下均为气态,其中Z气体
有色,并有下列转化关系(反应条件略去):K^S*5U.C

已知:甲分子中含有10个电子,乙分子含有18个电子;丙是一种常见化肥。请回答:
(1)Y的分子式是 ;
(2)Z的电子式是 ;
(3)实验室收集乙的方法是 ;
(4)工业上X与Y在一定条件下合成甲的化学方程式 ;
(5)甲与乙反应生成丙的化学方程式 。K^S*5U.C#O
II、(4分)有88 g D218O 和36 g H2O,试回答:K^S*5U.C
(1) 两者所含的分子数之比为_______ ;(2)两者所含的中子数之比为_______ 。
 “华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
“华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
2009-2010学年下学期第二次月考
19、(12分)已知ClO2是种易溶于水而难溶于有机溶剂的气体。实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+ Cl2 = 2ClO2+2NaCl。下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置省略),其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。请回答:
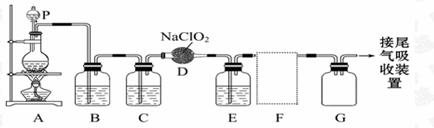

(1)仪器P、D的名称分别是 、 ;
(2)在NaClO2中Cl元素的化合价是______;
(3)写出A中烧瓶内反应的离子方程式: __________________________________;
(4)B装置中所盛试剂是__________________;
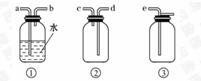
(5)F处应选用的收集装置是______(填序号),其中与E装置导管相连的导管口是______(填接口字母);

(6)G装置的作用是____________;
(7)若用100 mL 2 mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是______(填序号): A.>0.1 mol B.0.1 mol C.<0.1 mol D.无法判断
18.(10分)A、B、C、X为中学常见的物质,它们之间有如下转化关系(副产物已略去)



试回答:
(1)若X是还原性单质,则A可能是_______:A.金属 B.非金属
(2)若X是某种常见金属,B的溶液有颜色;向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀;C溶液在贮存时应加入少量X,理由是:
_____ (请用离子方程式表示);
检验此C溶液中金属阳离子的操作方法是:(请用离子方程式表示)
、 。
(3)若A、B、C为含有某种常见金属元素的化合物,X为强酸或强碱,则B的化
学式为___________ 。
17. (15分)短周期元素A、B、C、D、E、F的核电荷数按C、A、B、D、E、F的顺序增大;C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;E元素是自然界中含量最高的金属;B在同周期元素中半径最小 ;F的M层电子数是K层电子数的2倍。请回答:
(1)写出质子数比F多6的元素的名称: ______ ;
(2)元素B在周期表中位于第______周期、第______族 ;
(3)写出D2A的电子式: _______________;
(4)D的最高价氧化物的水化物中含有的化学键为______________________ ;
(5)由A、C、D三种元素组成的化合物M属于 ________ (填“离子”或“共价”)化合物,M溶于水后 ____ (填“是”或“否”)发生化学变化,原因是(从化学键的角度解释):
;
(6)写出D2A的水化物与E的氧化物反应的化学方程式:
。K^S*5U.C#O
16.在一定温度下,可逆反应A(g) + 3B(g)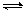 2C(g) 达到平衡的标志是( )
2C(g) 达到平衡的标志是( )
A.A、B、C、的分子数之比为1 ∶3 ∶ 2
B.A,B,C的浓度不再变化
C.单位时间生成n mol A,同时生成3n mol B
D.C生成的速率与A生成的速率相等
第Ⅱ卷(非选择题,共52分)
15.目前人类已发现的非金属元素除稀有气体外,共有16种。下列是对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸。请选择( )
A.只有②③正确 B.只有①③正确 C.只有④正确 D.均不正确
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com