
题目列表(包括答案和解析)
22.(11分)
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,为了检验SO2和C2H4的性质,有人设计下列实验方案。
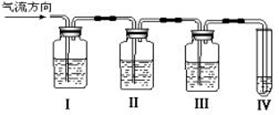
(1)I、II、III、IV装置可盛放的试剂是I ▲ ;II ▲;III ▲;IV ▲(将下列有关试剂的序号填入空格内); A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性KMnO4溶液 (2)能说明SO2气体存在的现象是 ▲ ;
(3)使用装置II的目的是 ▲ ;
(4)确定含有乙烯的现象是 ▲ 。 (5)如果Ⅳ盛放的溶液为溴水,那么发生的化学方程式为 ▲ ,反应类型为 ▲
(6)有同学认为乙烯和溴水反应也可能是取代反应,请你设计实验证明(包括操作、现象、结论) ▲
21.(4分)有下列八种物质:①氯化钡、②金刚石、③硫、④钨、⑤氯化钠、⑥钠、⑦二氧化硅、⑧干冰,回答有关这八种物质的问题。
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
|
各组中物质的编号 |
▲ |
▲ |
▲ |
▲ |
|
晶体类型 |
▲ |
▲ |
▲ |
▲ |
20.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是
A.电池工作时,锌失去电子 ,锌是负极
B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C.电池正极的电极反应式为:2MnO2+H2O+2e-== Mn2O3+2OH-
D.电池工作时,溶液中OH-向正极移动,K+、H+向负极移动
第Ⅱ卷(非选择题 共60分)
19.一定温度下,可逆反应2NO2  2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态。
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态。
A.①④⑤⑥ B.②③⑤⑥ C.①③④⑥ D.全部
18.25℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33 kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是
A.C(s)+ O2(g)=CO(g) △H= -396 kJ·mol-1
O2(g)=CO(g) △H= -396 kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -896 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
D.CH3OH(l)+ O2(g)=CO2(g)+2H2O(l) △H= +736kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H= +736kJ·mol-1
17.右图装置中久置后铁片会被腐蚀,有关此装置的叙述中正确的是

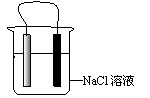 A.铁片为正极,碳棒为负极
A.铁片为正极,碳棒为负极
B.Na+ 在溶液中从C棒向Fe棒迁移
C.碳棒附近的溶液可使酚酞变红
D.导线上有电流通过,电流方向是由铁极流向碳极
16.已知:Zn+Cu2+===Cu+Zn2+,能实现该反应的原电池的正确组成是
|
|
A |
B |
C |
D |
|
正极 |
Zn |
Cu |
Cu |
Zn |
|
负极 |
Cu |
Zn |
Zn |
Zn |
|
电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
15.第ⅢA族的Al、Ga均为两性元素,已知Al的氢氧化物酸性比Ga的氢氧化物酸性弱,当CO2通入NaAlO2和NaGaO2的溶液中,首先沉淀出来的氢氧化物是
A.Al (OH)3 B.Ga(OH)3 C.同时沉淀出来 D.无法判断
14.下列各组物质性质的比较正确的是
A.酸性:H3PO4>H4SiO4>H2CO3 B.熔沸点:H2O>H2S>H2Se
C.离子半径:S2->Cl->K+ D.离子的氧化性:Na+>Mg2+>Al3+
13.下列说法不正确的是
A.第三周期非金属元素最高价氧化物对应的水化物的酸性从左到右依次增强
B.锗可能和硅一样,也是良好的半导体材料
C.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
D.同周期元素(除稀有气体元素外)的原子半径从左到右逐渐减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com