
题目列表(包括答案和解析)
1.十九世纪中叶,门捷列夫的突出贡献是 ( )
A.提出原子学说 B.发现元素周期律
C.提出分子学说 D.发现分子间作用力
22、(6分)9.6克A原子与4.2克B原子含有相同的原子数,A、B原子核中各自的质子数和中子数相等,已知A元素在其最高价氧化物中的质量分数为40%,在其氢化物中的质量分数为94.1%,试通过计算确定:A、B的相对原子质量及在元素周期表中的位置.(要有具体计算过程,只写答案无过程不给分)

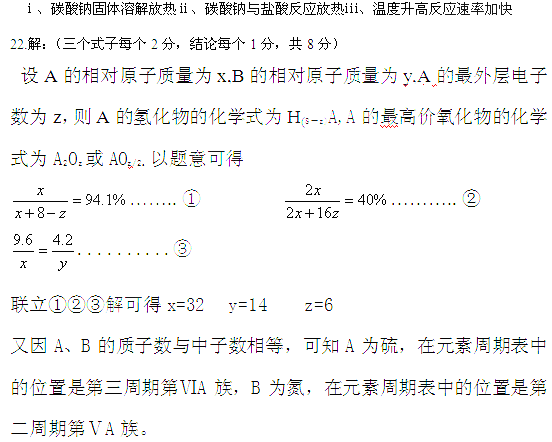
21、(1)在两支试管中分别加入3mL稀盐酸(均足量),分别将等质量的NaHCO3、Na2CO3粉末同时倒入试管中,甲同学用手触摸试管,发现加入NaHCO3粉末的试管变冷,而加入Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲下结论的方法是否正确?____________________(填正确或不正确)。
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前 温度 |
混合后最高 或最低温度 |
|
① |
50mL水 |
2.5gNaHCO3固体 |
20℃ |
18.5℃ |
|
② |
50mL水 |
3.2gNa2CO3固体 |
20℃ |
23.3℃ |
|
③ |
35mL稀盐酸 |
含2.5gNaHCO3的饱和溶液15mL |
20℃ |
18.8℃ |
|
④ |
35mL稀盐酸 |
含3.2gNa2CO3饱和溶液15mL |
20℃ |
21.2℃ |
|
⑤ |
50mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
17.4℃ |
|
⑥ |
50mL稀盐酸 |
3.2gNa2CO3固体 |
20℃ |
24.4℃ |
请你帮助填写相关内容:
①该研究报告的题目是《____ __ ________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、环形玻璃搅拌棒、胶头滴管、烧杯、量筒、保温瓶外,还需要的仪器名称为__________和___________;通过上述实验可得出三条结论:
a:NaHCO3的溶解是_________________________(吸热或放热)过程;
b:Na2CO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
c:NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应。
|
①OB段反应速率加快的原因
|
|||
 |
20、(11分)已知A、B、C、D、E是短周期的5种非金属元素,它们的原子序数依次递增,A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数 2倍。E元素和D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出元素的名称
A B C D E




 (2)画出E的阴离子的结构示意图:
(2)画出E的阴离子的结构示意图:


 (3)A的单质和C的单质在一定条件下反应生成化合物X,向X的水溶液中滴入酚酞,会观察到
,写出实验室制取X的化学方程式
(3)A的单质和C的单质在一定条件下反应生成化合物X,向X的水溶液中滴入酚酞,会观察到
,写出实验室制取X的化学方程式
(4)选取上述5种元素中的四种,可以分别形成两种离子化合物,这两种化合物的水溶液混合可以反应,生成盐、水和一种无色无味的气体,则这两种化合物的化学式为
19、(7分)A、B、C 3种元素,它们的离子具有相同的电子层结构.1molA单质与水反应能置换出1g氢气,而A变为具有跟氖原子相同电子层结构的离子.B单质与氢气在冷暗处能剧烈反应,并发生爆炸,B成为稳定的气态氢化物.C的氧化物的水化物既能溶于强酸也能溶于强碱.
(1)由此可知(写元素符号)A为________;B为________;C为________;
(2)完成下列化学方程式的离子方程式:
A单质与水________;C的氧化物的水化物溶于氢氧化钠溶液________.
18、按照要求写出三个化学反应方程式:(每个方程式3分,共9分)
①反应中的所有物质必须由短周期元素组成
②反应为置换反应
③不能是同主族的元素相互置换
④单质只能使用一次(包括生成的单质)
17、比较下列各组粒子及化合物的性质:(7分)
(1)硫的原子半径比氧 ,比硅 。(填“大”或“小”)
(2)S2-的还原性比Cl- ,比O2- 。(填“强”或“弱”)
(3)H2S的稳定性比PH3 ,比H2O 。(填“强”或“弱”)
(4)H2SO4的酸性比HClO4 。(填“强”或“弱”)
16、有M、R两种主族元素,已知R2-离子与M+离子核外电子数之和为20,则下列说法中不正确的是
A.R与M的质子数之和一定等于19
B.若R处于第三周期,则M必处于第二周期
 R与M元素组成的某种离子化合物中存在共价键
D.R与M的质子数之差可能等于7
R与M元素组成的某种离子化合物中存在共价键
D.R与M的质子数之差可能等于7
第Ⅱ卷 (非选择题 共52分)
15、 在一密闭容器中发生可逆反应:2NO2(g) 2NO(g) + O2(g)。该反应达到平衡状态的标志是
在一密闭容器中发生可逆反应:2NO2(g) 2NO(g) + O2(g)。该反应达到平衡状态的标志是
A.单位时间内生成n mol O2的同时,消耗2n mol NO2
B.单位时间内生成n mol O2的同时,生成2n mol NO
 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
D.混合气体的平均相对分子质量不再改变的状态
14、根据元素的单质和化合物的性质,判断元素非金属性强弱的依据一般是( )
A.元素最高价氧化物对应的水化物的碱性的强弱
B.元素氧化物对应的水化物的酸性的强弱
 元素的单质与酸反应置换出氢的难易
元素的单质与酸反应置换出氢的难易
D.元素的单质与氢气生成气态氢化物的难易以及氢化物的稳定性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com