
题目列表(包括答案和解析)
4、根据下列叙述能肯定A比B金属性强的是( )
A.常温下A能与水反应产生氧气而B不能
B.A原子的最外层电子数比B原子的最外层电子数少
C.单质A和单质B作电极与CuSO4溶液构成原电池,B上有Cu析出
D.1molA与足量盐酸反应生成的H2比1molB与足量盐酸反应生成的H2多
3、下列说法不正确的是 ( )
A.SiH4比CH4不稳定
B.O2-的半径比F-的半径大
C.Na和Cs属于第ⅠA族元素,Cs的失电子能力比Na的强
D.P和As属于ⅣA族元素,H3PO4的酸性比 H3AsO4的弱
2、XaYb是由二种短周期元素X﹑Y形成的一种离子化合物,其中二离子的核外电子层结构与稀有气体原子核外电子层结构相同。若X元素的原子序数为Z,则Y元素原子的质子数不可能是( )
A.Z+8-a-b B.Z-a-b
C.Z+16-a-b D.Z+10-a-b
1、下列说法不正确的是( )
A.现用元素周期表由七个周期和16个族构成
B.同周期ⅡA和ⅢA元素原子序数之差可能为1或11或25
C.三﹑四周期中两种同族元素原子序数之差不一定相同
D.现用元素周期表的第六纵行是ⅥA族
25. (9分) 已知有关物质的氧化性强弱顺序为 浓硫酸>Fe3+>H+>Fe2+。称得 60 g 铁粉与100 mL 浓硫酸在加热的条件下反应,反应最终有固体剩余,共收集到标准状况下气体22.4 L,气体的质量为39.2 g。试回答以下问题:(又知:2Fe 3++ Fe = 3Fe2+)
(1) 在加热的条件下开始反应到最终有固体剩余,还涉及到的化学方程式有:
_______________________________________________________________________;
(2) 求浓硫酸的物质的量浓度;
(3) 反应最终剩余固体的质量。(写出简单的计算过程)
(命题人:吴淑蓉 审题人:陈辉国)
西南师大附中2009-2010学年度下期期中考试
24. (8分) 化合物A俗称石灰氮,以前是一种常用的肥料,其含氮量为35.0%,含钙量为50%。它可以用CaCO3通过下列步骤制得:

请回答下列问题:
(1) 写出化学式:A________________、B________________;
(2) CaC2是__________________(填“离子”或“共价”)化合物;
(3) A与水完全反应的现象是产生白色沉淀并放出有刺激性气味的气体,写出A与水完全反应的化学方程式_______________________________________________________。
23. (18分)某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验。

(1) 先关闭活塞a,将6.4g铜片和12 mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:关闭活塞a ;
打开活塞a ;
②B是用来收集实验中产生的气体的装置,但导管未画全,请在上图中把导管补充完整;
③实验结束后,装置C中的溶液中可能含有的溶质有 。
(2) 该小组甲同学对“如何检验SO2中混有少许CO2”这个问题很感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置:
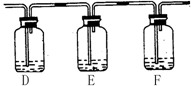
试剂:a. NaOH溶液 b. 品红溶液 c. 酸性KMnO4溶液 d. Ca(OH)2溶液
请回答:
①该同学的实验装置A中发生的化学方程式 。
②若要达到此目的,可以在:(填所提供试剂编号)
D中加入 ;E中加入 ;F中加入 。
(3) 事实证实,第(1)问铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度,假设反应前后溶液体积变化忽略不计,他向反应后溶液中加入含溶质a mol的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式: mol/L(用含a的代数式表达,若不能,该空不填)。
22. (12分) A、B是两种钠盐,且都是正盐,A中含有两种元素,B中含有三种元素,C是一种常 见的二元强酸,且A、B、C中皆含有同一元素,D有臭鸡蛋气味,它们在水溶液中有如下转化关系:

试回答:
(1) A、D、G的化学式分别为 、 、
(2) A、B、C反应只生成E和F的离子方程式为 。
(3)
要发生上述转化,A、B物质的量之比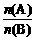 应满足的关系是
。
应满足的关系是
。
(4) 气体G可使高锰酸钾溶液褪色,发生反应的离子方程式为 。
21.
(14分) 有A、B、C、D、E 五种元素的原子序数依次增大,B、C 的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的氧化物既能与强酸反应,又能与强碱反应;D的原子结构示意图为: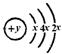 ;E的最外层电子数是电子层数的2倍。试回答下列各问题:
;E的最外层电子数是电子层数的2倍。试回答下列各问题:
(1) B、D元素分别为 、 ;
(2) D元素位于元素周期表中第 周期、第 族;
(3) 化合物B2A的电子式____________________;
(4) E的最高价氧化物的水化物的分子式是________________________。
(5) D与NaOH溶液反应的化学方程式:_______________________________________。
(6) C的氧化物与E的最高价氧化物的水化物溶液反应的离子方程式:
_______________________________________________________________________。
20. (7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生
请认真分析后回答下列问题:
(1) 原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2) 步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3) 原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com