
题目列表(包括答案和解析)
7.将 H2S、 SO2、 SO3 各0.01mol依次溶解于1L水中,则该溶液具有
A. 中性、漂白性 B. 酸性、漂白性 C. 只有酸性 D. 只有漂白性
6.对于下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.氨水可使酚酞试剂变为红色,说明氨溶解于水显弱碱性
5.A、B均为主族元素,A的原子序数为n,A2+离子比B2-离子少8个电子,则B元素的原子序数为
A.n+4 B.n+6 C.n+8 D.n+10
4. 下列物质的电子式正确的是
下列物质的电子式正确的是
3.下列物质均有漂白作用,但其中一种的漂白原理与其他三种不同的是
A.HClO B.过氧化钠 C. O3 D.SO2
(每小题只有一个正确答案,将正确选项填入相应的空格中,每小题2分,共20分) 1.澳大利亚研究人员最近开发出被称为第五形态的固体碳, 这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同种物质 B.同分异构体 C.同位素 D.同素异形体
2.互为同分异构体的物质一定不可能具有
A.相同的分子式 B.相同的结构 C.相似的化学性质 D. 相同的相对分子质量
30. 在500mL0.2 mol/L的稀硝酸中加入1.92克铜片,让其充分反应。试求.
(1)产生的气体在标准状况下占的体积?
(2)溶液中NO3-的物质的量浓度是多少?
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2mol/L的
氢氧化钠溶液多少毫升?
附加题:(5分)
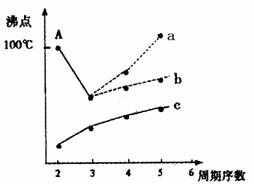
下图是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出
_______族元素氢化物的沸点的变化规律。另一同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是____ ,理由是: ________。
29.制取氨气并完成喷泉实验:
(1)写出实验室制取氨气的化学方程式:
______________________。
(2)氨气空间构型为_______.
(3)用图(Ⅰ)装置进行喷泉实验,上部烧瓶已装满干燥氨气,
引发水上喷的操作是____________________________。
(4)如果只提供如图(Ⅱ)的装置,请说明引发喷泉的方法。
__________________________________________________________
四: 计算题
28.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代号 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数 |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
b的离子半径大于e的离子半径;d是由共价键构成的四原子分子;c与f可形成两个共价型的g分子。
(1)a微粒的结构示意图为___________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较为________。
(3)c和f反应的离子方程式____________。

27. 现有部分短周期元素Y、M、Z、X,其原子序数依次增大,其微粒结构或性质特点如下表:
|
元素编号 |
元素微粒结构或性质特点 |
|
X |
标准状况下X2的密度为3.17g / L |
|
Y |
其原子最外层电子数为次外层电子数的2倍 |
|
Z |
最高价氧化物E是通讯材料光导纤维的主要原料 |
|
M |
M的最高价氧化物的水化物N是强碱 |
(1)M离子的离子结构示意图为: ;单质X2固态时熔化需克服 ;
(2)Y形成一种可用作装饰品的单质,其晶体的熔点与Z单质比较,熔点较高的的是 _____________(填化学式),Y与X形成一种YX4的化合物,其电子式为 。
(3)写出下列反应方程式:
①E与Y单质反应的化学方程式: 。
②N与X2单质反应的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com