
题目列表(包括答案和解析)
5.下列关于化学键的说法中正确的是
A.构成单质分子的微粒一定含有共价键
B.非极性键只存在于双原子单质分子里
C.不同元素组成的多原子分子里的化学键一定是极性键
D.由非金属组成的化合物不一定是共价化合物
4.用铁片和稀硫酸制取氢气,下列措施不能使氢气的生成速率加快的是
A.加热 B.将稀硫酸改为98%的浓硫酸
C.滴加少 量的硫酸铜溶液 D.将铁片改为铁粉
量的硫酸铜溶液 D.将铁片改为铁粉
3.对化学反应速率与化学反应限度的叙述,不正确的是
A.任何可逆反应都有一定的反应限度
B.反应温度是影响化学反应速率的决定性因素
C.化学反应的限度影响了反应物在该条件下的最大转化率
D.同一化学反应若反应条件不同限度可能不同
2.下列关于能源和作为能源物质的叙述中错误的是
A.人类利用的能源都是通过化学反应获得的
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
1. 通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是

A. B. C. D.
23.(10分)分析下列实例,根据已有的知识和经验,填写下表。
|
实
例 |
影响速率 的因素 |
如何影响 |
|
夏天食物易变质 |
|
|
|
硫在氧气中比在空气中燃烧快 |
|
|
|
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快 |
|
|
|
氯酸钾与二氧化锰混合共热可快速产生氧气 |
|
|
|
工业合成氨通常要在高压下进行 |
|
|
 解: 解: |
|
|
|
|
|
|
|
|
|
|
|
|
22.(9分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池,并回答下列问题:
①该电池的正极材料是 ,负极材料是 ,电解质溶液是 。
②在外电路中,电流方向是从 极到 极。
③正极上出现的现象是
负极上出现的现象是
21.(14分) A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A_________;B_________;C________;D________;
(2)C的一价阴离子的结构示意图__________________;
(3)D元素的最高价氧化物的结构式是_______________;
(4)C、D两元素形成的化合物电子式_____________________,分子内含有__________键
(填极性或非极性)。
|
21、(18分)已知A、B、C、D、E是短周期中的5中非金属元素,它们的原子序数依次增大,A元素原子形成的离子核外电子数是零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族,E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出下列元素的名称
B ;C ;E 。
(2)画出E的阴离子的结构示意图 ;
(3)A的单质和C的单质在一定条件下反应生成化合物X,该反应的化学方程式为 ;向X的水溶液中滴入酚酞,可观察到 。
(4)(6分)将9克的B单质在足量的D单质中燃烧,所得的气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是什么?其物质的量浓度分别是多大?
|
20、(8分)在400℃时,将一定量的SO2和14mol O2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2 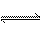 2SO3,已知2min后,容器中剩余2mol SO2和12mol O2,则:
2SO3,已知2min后,容器中剩余2mol SO2和12mol O2,则:
(1)生成了 mol SO3,SO2的起始物质的量浓度是 。
(2)2min内平均反应速率:v(SO2)是 mol/(L·min),v(SO3)是 mol/(L·min)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com