
题目列表(包括答案和解析)
26.(6分)短周期A、B、C、D 四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,可生成一种原子个数比为1:1的且不溶于水的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A元素的名称为 (2)B原子的阴离子的结构示意图为 。
(3)C元素位于元素周期表中第 周期、第 族。
(4) D的质子数和中子数相等。它的最高价氧化物对应的水化物化学式为: 。
(5)写出A、D两元素形成化合物的电子式 。
25.下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池的正极上发生氧化反应,负极上发生还原反应
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极
24.下列装置中能构成原电池的是




23.从手册上查得:H-H、Cl-Cl和 H-Cl的键能分别为436、243和431 kJ·mol-1,请用此数据估计,下列热化学方程式正确的是
A . H2(g)+Cl2(g)=2HCl(g); △H=-183 kJ·mol-1
B . H2(g)+Cl2(g)=2HCl(g); △H=+183kJ·mol-1
C . H2(g)+Cl2(g)=2HCl(g);△H=-91.5kJ·mol-1
D . H2(g)+Cl2(g)=2HCl(g);△H=+91.5kJ·mol-1
22.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,正确的是 A.钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e-=4OH一
B.亚硫酸氢钠溶液的电离方程式: NaHSO3 Na+ + HSO3一
Na+ + HSO3一
C.少量氢氧化钙溶液与碳酸氢钠溶液混合的离子方程式:Ca2++OH-+HCO3一=H2O+ CaCO3↓
D.表示氢气燃烧的热化学方程式2H2(g)+O2(g)=2H2O(l);△H=+571.6kJ·mol-1
21.下列说法中错误的是
A.CO燃烧是放热反应 B.H2SO4与NaOH反应是放热反应
C.CaO与H2O反应是吸热反应 D.CaCO3受热分解是吸热反应
20.用铁片与稀硫酸反应制取氢气是,下列的措施中,不能使氢气生成速率加快的是
A. 加热 B. 不用稀硫酸,改用98﹪浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
19.假设C+CO2 2CO(正反应为吸热反应)的反应速率是
2CO(正反应为吸热反应)的反应速率是 ,反应N2+3H2
,反应N2+3H2 2NH3(正反应为放热反应)的速率
2NH3(正反应为放热反应)的速率 ,当同时升高两反应的温度时,
,当同时升高两反应的温度时, 和
和 的变化情况为
的变化情况为
A. 减
减 增 B.同时增大 C.同时减少 D.
增 B.同时增大 C.同时减少 D. 增
增 减
减
18.可逆反应:2A(气) + 3B(气) 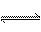 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.气体的总体积是反应开始时的 3/5
C.混合气体的密度不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
17.纳米是长度单位,1纳米等于1×10-9m,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是
A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快
B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快
C.常温下“纳米铜”比铜片的还原性强
D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com