
题目列表(包括答案和解析)
5.下列各组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是( )
A.食盐和蔗糖溶于水
 氯化钠和硫熔化
氯化钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
4.下列化学用语书写正确的是( )
A.氯原子的结构示意图:
 作为相对原子质量测定标准的碳核素:
作为相对原子质量测定标准的碳核素: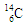
C.氯化镁的电子式:
D.用电子式表示氯化氢分子的形成过程:
3. 下列说法正确的是( )
A.离子化合物只能由金属元素和非金属元素组成
 离子化合物只能存在离子键
离子化合物只能存在离子键
C.盐酸能电离出氢离子和氯离子,所以HCl存在离子键
D.共价化合物中不可能存在离子键
2.下列关于物质性质的比较,正确的是 ( )
A.相同温度下,水中的溶解度:NaHCO3>Na2CO3
 熔点:铯>钾>钠>钠和钾的合金
熔点:铯>钾>钠>钠和钾的合金
C.熔沸点:HI>HBr>HCl>HF
D.热稳定性:HF>HCl>HBr>HI
1.下列关于物质性质变化的比较, 不正确的是 ( )
A.
酸性强弱:
HIO4>HBrO4>HClO4  原子半径大小:
Na > S > O
原子半径大小:
Na > S > O
C. 碱性强弱: KOH > NaOH > LiOH D. 还原性强弱: F- < Cl- < I-
36.(6分)元素X的某核素AzX的核外电子数等于核内中子数,取核素形成的单质2.8g跟O2充分反应,可得到6g化合物XO2。则A是多少?该元素是什么?在周期表中的位置是?
.w.^w.k.&s.5*=
衡水中学2009-2010学年度下学期期中考试
35.(10分)现有如下两个反应:(A)NaOH + HCl = NaCl + H2O (B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A) (B)
|
(3)如果(A或B)可以,则画出装装置图并写出
正、负极的电极反应式
负极:
正极:
.w.^w.k.&s.5*=
34. (6分)化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:
(6分)化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:
P-P 198kJ、 P-O 360 kJ、 O=O 498 kJ
已知:白磷(P4)和P4O6的分子结构如图所示。
白磷燃烧生成P4O6
(1)白磷和P4O6中的化学键类型分别为 和
(2)1mol P4 燃烧生成P4O6时放出 kJ热量 。
33.(18分)下表是元素周期表的一部分。
|
.w.^w.k.&s.5*= |
II A |
.w.^w.k.&s.5*= |
IV A |
|
.w.^w.k.&s.5*= |
VII A |
||
|
1 |
① |
.w.^w.k.&s.5*= |
|||||||
|
2 |
|
|
|
② |
③ |
④ |
⑤ |
||
|
|
⑥ |
|
⑦ |
|
|
⑧ |
⑨ |
||
|
.w.^w.k.&s.5*= |
|
⑩ |
|
.w.^w.k.&s.5*= |
|
|
 |
(1)表中所列元素中,最稳定的气态氢化物的化学式 ,
原子半径最小的元素的元素符号是 。
(2)某元素原子的核外M层电子数是元素②最外层电子数的1/2,则该元素的元素符号是 ,其元素原子结构示意图为 。
(3)某元素是组成蛋白质的重要成分,蛋白质又是生命的存在形式,因此此元素被称为“生命元
素”,此元素的名称为 ,其单质的电子式为 ,
用化学方程式表示其单质的一种重要的工业用途: 。
(4)④与⑥形成原子个数之比为1∶1的化合物的电子式为 ,
用电子式表示⑤和⑩形成化合物的过程
(5)写出下列化学方程式
⑤的单质通入⑥和⑨形成化合物的水溶液中
⑨的单质通入⑥和 形成化合物的水溶液中
形成化合物的水溶液中
Ⅱ、在①126C ②3919K ③4020Ca ④136C ⑤147N ⑥4018Ar中:(用序号填空)
(1)互为同位素的是 和 ;
(2)质量数相等,但不能互称同位素的是 和 ;
(3)中子数相等,但质子数不相等的是 和 , 和
32.(11分)下图表示某种分子结构的电键图,大黑点表示从1-10号的原子实(原子实指原子除去最外层电子后的剩余部分),小黑点代表未用于成键的最外层电子,短线表示成键电子对(如
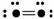 表示O2)
表示O2)
现有 A
 B
B  C
C 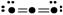 D
D 
(1)据上图写出它们的化学式A B C D
(2)写出工业制取C的化学方程式
该反应为 反应(填“吸热”或“放热”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com