
题目列表(包括答案和解析)
20. 已知25℃、101kPa下,1 mol石墨、金刚石燃烧放出的热量分别为: C(石墨)+O2(g)=CO2(g) 放出393.51kJ
C(金刚石)+O2(g)=CO2(g) 放出395.41 kJ
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
19. 同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO 4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A.原子半径:X>Y>Z B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z D.原子序数:Z>Y>X
18. 关于周期表和周期律,下列说法中正确的是( )
A. 在周期表中,元素的族序数都等于其原子的最外层电子数
B. VIIA族元素的单质,随相对分子质量的增大,熔、沸点升高;IA族单质,由上至下, 随相对原子质量递增,熔、沸点下降
C.周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强
D. 同主族元素随原子核电荷数的递增,原子半径依次增大
17. 已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.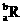 B.
B.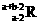 C.
C.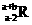 D.
D.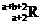
16. 氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是( )
A. NaH在水中显酸性 B. NaH中氢离子半径比锂离子相等
C. NaH中氢离子电子排布与氦原子相同 D.NaH中氢离子可以被还原成氢气
15.下列叙述正确的是( )
A. 分子是由一定数目的原子组成的,原子之间的相互作用叫化学键
B. 按C、N、O、F的顺序,元素的最高正价依次升高
C. 非金属元素之间构成的化合物都不是离子化合物
D. 离子化合物中一定含有离子键
14. 下列关于物质性质变化的比较, 正确的是( ) A. 酸性强弱: HI<HBr<HCl<HF B. 原子半径大小: Na > S > O C. 碱性强弱: KOH<NaOH<LiOH D. 还原性强弱: F- > Cl- > I-
13. 某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )
A.R一定是第四周期元素 B.R一定是ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2R
12. 元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
11. 将甲、已两种金属的性质相比较,已知
① 甲跟水反应比乙与水反应剧烈
② 甲单质能从乙的盐溶液中置换出单质乙
③ 甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④ 与某金属反应时甲原子得电子数目比乙的多
⑤ 以甲、乙金属为电极构成原电池,甲作负极
能说明甲的金属性比乙强的是
A.①④ B.③⑤ C.①②③⑤ D.①②③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com