
题目列表(包括答案和解析)
19、某元素X能形成气态氢话物HnX,该气态氢化物在标准状况下的密度为1.629g/L,它的水溶液可和纯碱反应放出CO2气体,此时反应物的物质的量之比为2 :1。
(1)(5分)计算X的相原子质量(取小数点后面一位)
(2)(5分)100 mL HnX的水溶液与纯碱反应产生336 mLCO2气体,求HnX溶液中溶质的物质的量浓度。
蚌埠二中2009-2010学年度第二学期期中考试
18、根据下图回答问题:

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。_______________________________。
(2)写出浓硫酸和木碳粉在加热条件下发生反应的化学方程式:_____________
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂和作用是______ ______。
B中加入的试剂和作用是________ _________。
D中加入的试剂和作用是____ ___________。
(4)实验时,C中应观察到的现象是__________________ _________________。
17、(12分)A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: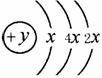 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为(用元素符号表示):
。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
(4)A的气态氢化物在空气中可以自燃,其化学方程式为:
。
15、(12分)短周期元素A、B、C、D,已知常温下A单质是黄绿色气体;B元素原子核外电子排布比A原子少一个电子层,且最高价氧化物对应水化物是强酸;C元素的原子失去2个电子后转化成为具有两个电子层的离子;D元素和A元素处在同一周期,0.2molD的单质和足量的稀盐酸反应,在标准状况下生成6.72升氢气。请回答下列问题:
(1)A元素的名称__ _____, B单质的分子式___ ___,
C离子的电子式__ _____,D元素的元素符号__ ___。
(2)A、B、C、D四种元素原子半径由大到小的顺序是 (用ABCD表示)。
 (3)C单质在B单质中反应的化学方程式:
。
(3)C单质在B单质中反应的化学方程式:
。
14、 镁是生产铝合金必需的添加材料。镁合金被公认为“二十一世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域。目前全世界的镁金属年产量为60万吨,其中约80%由中国生产。现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率没有影响的是( )
镁是生产铝合金必需的添加材料。镁合金被公认为“二十一世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域。目前全世界的镁金属年产量为60万吨,其中约80%由中国生产。现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率没有影响的是( )
A、溶液的温度 B、镁条的表面积 C、Cl-的浓度 D、H+的浓度
第Ⅱ卷(非选择题 共58分)
13、运用元素周期表的变化规律,下列判断不正确的是( )
A、铍是一种轻金属,它的氧化物对应的水化物可能是两性氢氧化物
B、硫酸锶(锶为IIA族)难溶于水和稀硝酸,其氢氧化物一定是强碱
C、砹是一种有色固体,它的气态氢化物很稳定
D、碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
12、硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒不可能具有的性质为:
A、在通常状况下是固体 B、SeO3的水化物为酸
C、H2Se比H2S稳定 D、硒元素有+4、+6、-2三种常见化合价
11、反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A、υ (C)=0.5 mol / (L·s) B、υ(D)=0.4 mol / (L·s)
C、υ(B)=0.6 mol / (L·s) D、υ(A)=0.15 mol / (L·s)
10、下列叙述中正确的是( )
A、离子化合物中不一定含有金属元素
B、同周期元素的原子半径越小, 越容易失去电子
C、同周期非金属元素的原子半径越小, 气态氢化物的稳定性越弱
D、离子化合物都属于强电解质, 一定都易溶解于水
9、A和B为短周期元素, A- 和 B2+ 具有相同的电子层结构, 下列比较中正确的是( )
A、原子半径 A > B B、离子半径 A- > B2+
C、A在B的下一周期 D、A可能是金属元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com