
题目列表(包括答案和解析)
1、下列说法都正确的是
①使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
②四川灾区重建使用了大量钢材,钢材是合金
③积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
A.①②③④ B.①②④⑥ C.①②⑤⑥ D.②③④⑤⑥
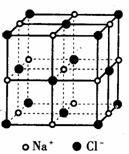
29.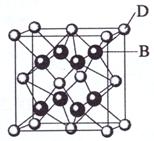 (15分)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B是所有元素中电负性最大的元素。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第6列元素。D的原子序数比E小4,D跟B可形成离子化合物其晶胞结构如右图。
(15分)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B是所有元素中电负性最大的元素。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第6列元素。D的原子序数比E小4,D跟B可形成离子化合物其晶胞结构如右图。
请回答:
(1)A元素单质的电子式是 ;
(2) B单质的分子式为 ,C的元素符号是 。B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,名称是 。它的基态原子的电子排布式为 :
(4)从图中可以看出,D跟B形成了离子化合物,请用电子式表示该离子化合物的形成过程 ;
该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
沁源中学2009-2010学年高二期中考试
27. (8分)下图是元素周期表中的前四周期,①-⑨为相应的元素,请从中选择合适的元素回答问题:
|
① |
|
|
|||||||||||||||
|
|
|
|
② |
③ |
④ |
⑤ |
⑥ |
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
⑦ |
|
|
⑧ |
⑨ |
|
|
|
|
|
|
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的 区。
(2)②、⑥两元素形成的化合物的空间构型为 ,其中心原子的杂化轨道类型为 。
(3)写出元素⑧基态原子的电子排布式 。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为: 。
(5)元素⑦与CO可形成的 X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于 晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为 。
(7) 金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。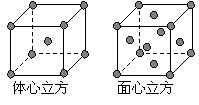 则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
26. (8分) 已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 型,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
25.(8分)已知元素的电负性和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素电负性的数值:
|
元素 |
Al |
B |
Be |
C |
Br |
F |
Li |
|
电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
电负性 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
试结合元素周期律知识完成下列问题:
(1)试推断AlBr3、Na F中的化学键类型分别是 、 。
(2)根据上表给出的数据,简述主族元素电负性的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)电负性的数值大小与原子半径之间的关系___________________。
(3)请你预测Br与I元素的电负性的大小关系Br____I。
(4)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于______原子(填元素符号)。
24. 已知食盐晶体的密度为ρg·cm-3,若右图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为
A. 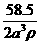 B.
B.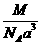 C.
C. 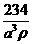 D.
D. 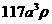
第Ⅱ卷(非选择题,共52分)
23. 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
 B.第一电离能Y一定小于X
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
22. 下列物质不能溶于浓氨水的是
A. Fe(OH)3 B.Cu(OH)2 C.AgOH D. AgCl
21. 下列氯元素含氧酸酸性最强的是
A.HClO B. HClO4 C.HClO3 D. HClO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com