
题目列表(包括答案和解析)
1、决定元素种类的是
A、电子数 B、中子数 C、质子数 D、质子数和中子数
25.(7分)U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:
①WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;K^S*
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)WU3分子的空间构型为 ,其水溶液呈 性。
 (2)写出Y2X2与水反应的化学方程式:
。
(2)写出Y2X2与水反应的化学方程式:
。
(3)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
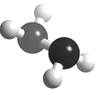
(4)已知下图的球棍模型所表示的是由U、W两种元素组成的
共价化合物A,已知某些火箭发射中常用A为燃料,0.1 mol A
(气态)在X的单质(气态)中燃烧生成两种无污染的气态产物,并放出53.4 kJ的热量, 则其热化学方程式为
福州市八县(市)协作校2009-2010学年第二学期半期联考
24.(10分) 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
|
④将镁条投入稀盐酸中 |
D.生成白色胶状沉淀,继而沉淀消失 |
|
⑤向A1Cl3溶液中滴加NaOH溶液至过量 |
E.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告
(1)实验目的:研究 元素性质递变规律。K^S*
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等
仪器:试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴,烧杯,还缺少的仪器有 , 。
(3)实验内容:(填写与实验步骤对应的实验现象的编号及此实验的结论)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
|
实验现象(填A~F) |
|
|
|
|
|
此实验的结论是为
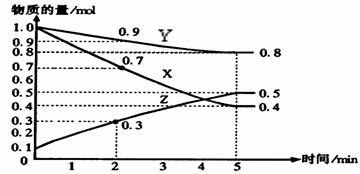
23.(5分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为_____________________
(2)反应开始至2min内 Z的平均反应速率为______________;
(3)5min后Z的生成速率比5min末Z的生成速率_______________(大、小、相等)。
K^S*
22.(7分) 致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O>HF;
(2)化合物的毒性: PH3>NH3 ; H2S H2O;CCl4 CF4 (选填>或<)。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似于CF2Cl2的物质还可能有 。(填一种);这类致冷剂的大量使用造成了当今的某一环境问题是  (选填:温室效应、酸雨、臭氧层空洞、光化学烟雾)^S*
(选填:温室效应、酸雨、臭氧层空洞、光化学烟雾)^S*
(4)根据周期表中元素及其化合物的 变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色 (a)①②③ (b)②④⑤ (c)②③④
21.(4分)在一密闭的2L容器里装有4molSO2和2molO2,在一定条件下开始反应。2min末达到平衡状态,测得容器中有2.4mol SO3,则(1)达到平衡时O2的浓度是 ;(2)平衡时SO2的转化率为 。
20.(4分)下列物质中:(填序号)
(1)互为同分异构体的有 (2)互为同素异形体的有
(3)属于同位素的有 (4)属于同一种物质的有 。
①液氯
②白磷 ③  Cl
④氯气 ⑤氯水
Cl
④氯气 ⑤氯水
 ⑥ ⑦
⑥ ⑦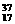 Cl ⑧红磷 ⑨
Cl ⑧红磷 ⑨ 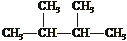
19.(9分)下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
1 |
A |
|
|
|
|
|
|
|
|
2 |
|
|
|
D |
E |
|
G |
I |
|
3 |
B |
|
C |
|
F |
|
H |
|
(1)表中元素,化学性质最不活泼的是___________,氧化性最强的单质是___________,还原性最强的单质是___________;
(2)最高价氧化物的水化物碱性最强的是___________,酸性最强的是___________;
(3)E单质的结构式为_________; D元素最高价氧化物的电子式为__________;
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式_________________________________________________________。
18.下列说法正确的是 ( )
A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.ⅤⅡA族元素中,非金属性最强的元素其无氧酸酸性也最强
D.第三周期元素的离子半径从左到右逐渐减小
第二卷(非选择题 共46分)
17.一定温度下反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是( )
2NH3(g)达到化学平衡状态的标志是( )
A.N2与H2的物质的量之和是NH3的物质的量2倍
B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.N2、H2和NH3的物质的量分数不再改变
D.单位时间里每增加1molN2,同时减少2molNH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com