
题目列表(包括答案和解析)
6.下列各组物质的类别归属正确的是
A.同位素:1H2、2H2、3H2
B.分子晶体:I2、干冰、Na
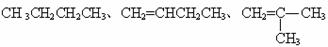 C.同分异构体:
C.同分异构体:
D.同素异形体:石墨、金刚石、C60
5.下列表示物质结构的化学用语或模型正确的是
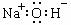 A.8个中子的碳原子的核素符号:12C B.氢氧化钠的电子式:
A.8个中子的碳原子的核素符号:12C B.氢氧化钠的电子式:
 C.Cl-离子的结构示意图:
C.Cl-离子的结构示意图: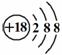 D.CH4分子的比例模型:
D.CH4分子的比例模型:
4.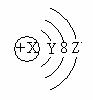 右图是某粒子W的结构示意图,下列关于它的说法不正确的是
右图是某粒子W的结构示意图,下列关于它的说法不正确的是
A.Y=2
B.若X=18,则Z=8
C.若X=11,它的氧化物化学式可为W2O或W2O2
D.若X=15,它属于金属元素的原子
3.在下列元素中,不属于主族元素的是
A.氢 B.铁 C.钙 D.碘
2.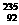 U是核电站的主要燃料,下列关于
U是核电站的主要燃料,下列关于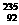 U的说法正确的是
U的说法正确的是
A.质子数为235 B.中子数为92
C.电子数为143 D.质量数为235
1.美国科学家近年宣称:普通盐水在无线电波照射下可燃烧,这伟大的发现,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是
A.分子间作用力 B.氢键 C.共价键 D.离子键
19.(11分)Cu-Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),一化学研究性学习小组对其进行如下探究,请按要求完成下列探究报告。
[探究目的]实验测定样品中Fe,Cu的质量。
[探究思路]设计实验测量有关反应物和生成物的量,并通过计算确定样品中Fe,Cu的质量。
[实验探究](本实验中的气体体积均已换算成标准状况)
①将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体测得其体积为VmL。过滤得浅绿色溶液A(不含Cu2+),还有滤渣B。
②将滤渣B投入到一定浓度的HNO3中,完全溶解,收集产生的气体,经分析气体是NO和NO2的混合气体,总体积896mL,其中NO2体积为224mL。
③将①中所得的滤液加入到足量的稀HNO3中,充分反应后再加入足量的NaOH溶液,将产生的沉淀全部滤出,充分加热灼烧得红棕色固体,称量该固体的质量为3.2g。
[结果处理]
(1)A中存在的阳离子有 ▲____,滤渣B为__ ▲_____。
(2)依次写出步骤③中加入HNO3时发生反应的离子反应方程式 ▲ 。
(3)被腐蚀前的合金中Fe的质量为__ ▲___g,Cu的质量为__ ▲___g。
(4)实验探究①中V为 ▲ mL。
命题、校对:蔡秀忠、赵飞雪
审核:鞠东胜、洪 强 王思亮
18.(10分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
17.(12分)如图甲为氢氧燃料电池装置示意图(已标明电池工作时OH-的移动方向),A、B、C、D为电极。
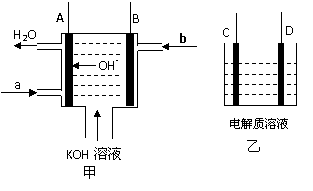
(1)若A、B连接外电阻并形成回路,则A电极的电极反应式 ▲ ,b处通入的气体
为 ▲ 。若乙中C为Fe、D石墨,电解质为NaCl,则导线连接C、D后,D电极
的电极反应式 ▲ 。
(2)若乙中C、D均为石墨,电解质溶液为滴有酚酞的NaCl溶液,用导线将A与D相连、
B与C相连,则一段时间后 ▲ 极附近的溶液呈红色,乙中总反应的化学方程式为 ▲_。
(3) 若乙中C为粗铜、D为纯铜片,电解质溶液为硫酸酸化的硫酸铜溶液,用导线将A与
D相连、B与C相连,则乙中D电极的电极反应式 ▲ 。当甲中b气体消耗0.1 mol
时,理论上乙中某电极增重 ▲ g
16.(11分)已知:298K时,N2(g)+3H2(g) 2NH3(g) △H = -92.2kJ·mol-1。
2NH3(g) △H = -92.2kJ·mol-1。
(1)若N≡N的键能为941.3 kJ·mol-1,H-H的键能为436.4 kJ·mol-1,则N-H的键能为 ▲ 。
(2)实验室将1.1mol N2、3mol H2充入2 L容器,一定条件下反应。
①若2 min末测得H2的物质的量为1.8 mol,则该时间段内氨气的平均反应速率为 ▲ 。
②下列措施可加快该反应速率的是 ▲ 。
A.充入He气 B.使用恰当的催化剂
C.升高反应体系的温度 D.再充入N2
③当下列物理量保持不变时,表明该反应一定处于化学平衡状态的是 ▲ 。
A.容器内N2与H2的浓度比 B.容器内气体密度
C.恒温下入侵压强 D.H2的物质的量
④充分反应后恢复到298K,反应w*w^w.k&s#5@过程中放出的热量 ▲ 92.2kJ(填“>”、“=”、“<”),理由 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com