
题目列表(包括答案和解析)
25.(10分)在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min ,铁粉完全溶解。则
(1)在前2min 内用FeCl2表示的平均反应速率是 mol·L-1·min-1。
(2)在后4min内用HCl表示的平均反应速率是 mol·L-1·min-1。
B类题
24.(20分)A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
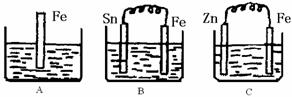
(1)A中反应的离子方程式为 。
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= mol·L-1。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 (填写序号)。
23.(15分)下表是元素周期表的一部分(注意:以下各空所涉及的元素填元素符号,不能用字母代替)
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
IVA |
VA |
VIA |
VIIA |
0族 |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
G |
H |
|
D |
|
|
3 |
B |
|
C |
|
|
|
E |
|
|
4 |
F |
A |
|
|
|
|
|
|
(1)用电子式表示AD2的形成过程 。
(2)写出C的最高价氧化物对应的水化物和E的最高价氧化物对应的水化物反应的离子方程式
。
(3)请设计实验比较B、F的金属性强弱顺序。
|
元素 |
实验设计 |
现象 |
结论 |
|
B |
|
|
金属性:B F (填“>”、“<”或“=”) |
|
F |
22.(27分)有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Z2的电子式为 ,Y的原子结构示意图为 ,YW2的结构式为 。

(2)将YX4、W2按上图所示通入某燃料电池中,则两极的电极方程式分别为:
a电极: ,b电极: 。若有16gW2参加反应,转移的电子数是 。
(3)已知在120℃、101kPa下, 0.5mol X2在W2中完全燃烧时,释放出120.9kJ的热量,该反应的热化学方程式为 。
(4)Y和Z结合可生成一种超硬物质,本身耐磨损,抗腐蚀,则该物质属于 晶体,该晶体中各粒子均满足8电子稳定结构,则化学式为 。
第II卷(选做题,45分)
友情提醒:
本部分试卷分为A、B两类,同学们可以选做A、B两类中任何一类,但选择要统一,不可两类混做,多做或混做均不得分。
A类题
3.0 mol·L-1盐酸与铝片反应的现象却十分明显。
(1)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________。
(2)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪
些假设或猜想(列出两种即可)?
假设一:__________________ 假设二:____________________
21.(6分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0 mol·L-1盐酸、1.5 mol·L-1硫酸、3.0 mol·L-1硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0 mol·L-1盐酸、1.5 mol·L-1硫酸、3.0 mol·L-1硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5 mol·L-1硫酸还是3.0 mol·L-1硫酸,均无明显的现象,而
20.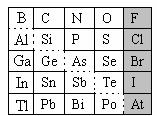 (12分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(12分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)元素Si在元素周期表中的位置为:第 周期第 族。
(2)热稳定性:H2O H2S(填“>”、“<”或“=”)。
(3)可在图中分界线(虚线部分)附近寻找 。(填序号)
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(4)根据元素周期律,预测:
①阴影部分元素中最高价氧化物对应水化物的酸性最强的是 元素。(填元素符号)
②H3AsO4、H2SeO4 的酸性强弱:H3AsO4 H2SeO4(填“>”、“<”或“=”)。
19.(6分)已知:
① CaCO3
(s)  CaO
(s) + CO2 (g) Δ H = +178.2 kJ·mol-1
CaO
(s) + CO2 (g) Δ H = +178.2 kJ·mol-1
② 2Na (s) +
Cl 2 (g)  2NaCl (s) Δ H = -822.0
kJ·mol-1
2NaCl (s) Δ H = -822.0
kJ·mol-1
③ H-H、Cl-Cl和 H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1
则:
(1)上述反应①②中属于放热反应的是 (填序号)。
(2)根据②计算生成1 mol NaCl(s)时,Δ H = ____ kJ·mol-1。
(3)根据③推算:Cl 2
(g) + H2 (g)  2HCl
(g) 的Δ H = kJ·mol-1。
2HCl
(g) 的Δ H = kJ·mol-1。
18.关于下列图示的说法中正确的是
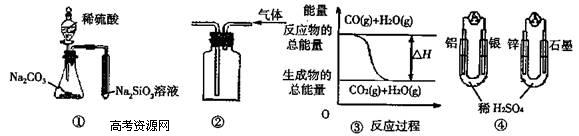
A.用图 ① 所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图 ② 所示实验装置排空气法收集CO2气体
 C.图 ③ 表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H>0
C.图 ③ 表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H>0
D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
17.CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),
CH3CH2OH(g)+H2O(g),
下列叙述中能说明上述反应在一定条件下已达到最大限度的是
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1∶2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com