
题目列表(包括答案和解析)
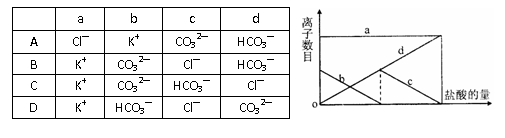
13.向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是 ( )w*w^w.k&s#5@
12.常温下,某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH- ) 。下列判断正确的是 ( )
A.该溶液可能由0.1 mol/L的CH3COOH与0.1 mol/L的NaOH溶液等体积混合而成
B.该溶液可能由0.2 mol/L的CH3COOH与0.1 mol/L的NaOH溶液等体积混合而成
C.该溶液可能由pH =3的CH3COOH与pH =11的NaOH溶液等体积混合而成
D.在该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为:
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
11.对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
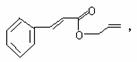
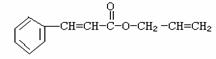 可简化为
可简化为
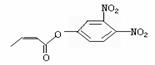 杀虫剂“阿乐丹”的结构表示为
, 若它在稀酸作用下
杀虫剂“阿乐丹”的结构表示为
, 若它在稀酸作用下
能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是 ( )
A.遇FeCl3溶液均显紫色 B.均能发生银镜反应
C.均能与溴水发生取代反应 D.均能与NaOH溶液发生反应
10.下列反应的离子方程式正确的是 ( )
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ → Fe3+ + 3H2O
B.明矾净水的离子方程式w*w^w.k&s#5@:Al3+ + 3H2O
 Al(OH)3
(胶体) + 3H+
Al(OH)3
(胶体) + 3H+
C.过氧化钠投入重水中:2Na2O2 + 2D2O→4Na+ + O2↑+ 4OD-
D.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:
Ba2++2OH- +2HCO3-→BaCO3↓+2H2O + CO32―
9.根据下列实验现象,所得结论正确的是 ( )
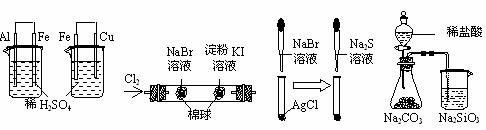
A B C D
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
8.下列各组离子,在指定环境中一定能大量共存的是 ( )
A.在pH>7的溶液中,Na+、S2-、K+、AlO2-
B.在由水电离子的c(H+)=1×10-13mol/L的溶液中,SO42-、S2-、K+、NH4+
C.溶解有Na2CO3的溶液中,Al3+、Cu2+、Cl-、NO3-
D.在pH=0的溶液中,Fe2+、ClO-、Na+、SO42-w*w^w.k&s#5@
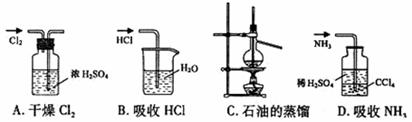
7.用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是 ( )
6.下列有关原子结构和元素周期律的表述正确的是 ( )
① 原子序数为15的元素的最高化合价为+3 ② ⅦA族元素是同周期中非金属性最强的元素 ③ 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④ 原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
5.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱条件下生成ClO-,把二价镍氧化成三价镍。以下说法正确的是( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2 Cl- + 2e- = Cl2
D.2 mol二价镍全部转为三价镍时,外电路中通过了2 mol电子
4.如右图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾。则A与B可能是 ( )?A.水与氮气 w*w^w.k&s#5@
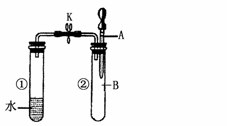 B.稀硫酸与一氧化碳
B.稀硫酸与一氧化碳
C.饱和食盐水与氯气
D.浓氢氧化钠溶液与二氧化碳
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com