
题目列表(包括答案和解析)
12.反应4NH3(g)+5O2(g)
 4NO(g)+6H2O(g), 在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率ν(X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(g)+6H2O(g), 在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率ν(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. v(NH3)=0.010mol·L-1·S-1 B. v(O2)=0.001mol·L-1·S-1
C.v(NO)=0.0010mol·L-1·S-1 D. v(H2O)=0.045mol·L-1·S-1
11.已知化学反应2C(S)+O2(g) 2CO(g);2CO(g)+O2(g)
2CO(g);2CO(g)+O2(g) 2CO2(g)都是放热反应。据此推断,下列说法不正确的是(
)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(
)
A.1molC所具有的能量一定高于1molCO所具有的能量
B.2molCO和1molO2所具有的总能量大于2molCO2所具有的总能量
C.1molC和1molO2所具有的总能量大于1molCO2所具有的总能量
D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
10.设NA表示阿伏加德罗常数,下列说法中正确的是( )
A.62 g Na2O溶于水后所得溶液中含有O2-离子数为NA
B.含4 molHCl的浓盐酸与足量MnO2反应可生成NA个氯分子
C.1mol异丁烷分子中含有共价键的数目为13NA
D.7.8gNa2O2晶体中所含离子的总数为0.2NA
9.氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是( )
A. NaH在水中显酸性 B. NaH中氢离子半径比锂离子小
C. NaH中氢离子电子排布与氦相同 D.NaH中氢离子被还原成氢气
8. 在铝与稀硫酸的反应中,已知1 min末硫酸的浓度减少了3.6 mol/L,若不考虑反应过程中溶液体积的变化,则1 min 内生成硫酸铝的平均反应速率是 ( )
A. 2.0 mol/(L•min) B. 1.2 mol/(L•min) C. 1.8mol/(L•min) D.3.6 mol/(L•min)
7.下列各组中的两种物质作用时,反应条件(温度、反应物用量,浓度)改变,不会引起产物种类改变的是( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.Zn 和H2SO4
6. 有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.判断它们活动性由强到弱的顺序是 ( )
A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c
5. 下列装置中,能组成原电池的是:( )
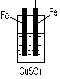
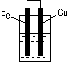
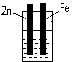
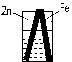
酒精 稀硫酸 稀硫酸
A B C D
4.下列化学用语中,正确的是( )
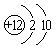
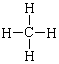
A. 甲烷的结构式: B. 镁的原子结构示意图:
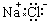 C. 氯化钠的电子式:
D. 乙烷的结构式:CH3CH3
C. 氯化钠的电子式:
D. 乙烷的结构式:CH3CH3
3.与氢氧根具有相同质子数和电子数的微粒是 ( )
A.F- B.Cl- C.NH3 D.NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com