
题目列表(包括答案和解析)
22.下列离子方程式正确的是( )
A.等物质的量浓度的Ba(OH)2溶液与Al2(SO4)3溶液以体积比为3:1混合
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)2溶于足量稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O
C.氨气通入醋酸溶液中 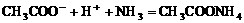
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO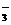 +OH-== CO
+OH-== CO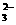 +H2O
+H2O
21.用足量铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率变快但不影响氢气量的是( ) A.加少量Na2SO4固体 B.少量CuSO4晶体 C.不用稀硫酸,改用98%浓硫酸 D.不用铁片,改用铁粉
20. 在某一容积为2 L的密闭容器内,加入2 mol的CO和2 mol的H2O,高温加热,发生如下反应:CO(g) +H2O(g)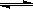 CO2(g)
+ H2(g);1molCO完全反应放热a
kJ。反应达到平衡后,测得n(CO2)=
0.8mol下列说法正确的是( )
A.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
B.反应放出的热量为0.4a kJ C.平衡时H2O 的转化率为40%
D.加入催化剂可以反应加快,放热更多
CO2(g)
+ H2(g);1molCO完全反应放热a
kJ。反应达到平衡后,测得n(CO2)=
0.8mol下列说法正确的是( )
A.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
B.反应放出的热量为0.4a kJ C.平衡时H2O 的转化率为40%
D.加入催化剂可以反应加快,放热更多
19. 一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g。原混合气体中CO2的质量为( )
一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g。原混合气体中CO2的质量为( )
A.12.5g B.13.2g C.19.7g D.24.4g
18. A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是( )
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C. A、B、C三种元素非金属性依次增强
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
17.甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,依次通过下列哪组洗气瓶( )
A.溴水,浓H2SO4 B.澄清石灰水,浓H2SO4
C.酸性高锰酸钾溶液,浓H2SO4 D.浓H2SO4,酸性高锰酸钾溶液
16.下列叙述正确的是( )
A.两种原子构成的共价化合物分子中的化学键都是极性键
B.两种不同非金属元素原子间形成的化学键都是极性键
C.非金属单质分子中一定含有非极性键
D.含有非极性键的化合物不一定是共价化合物
15.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-== C6Li1-x+xLi+ 正极反应:Li1-xMO2+xLi++x e-== LiMO2
下列有关说法正确的是( )
A.锂离子电池放电时电池反应为LiMO2+C6Li1-x ==C6Li+Li1-xMO2
B.电池反应中,锂、锌各失去1mol电子,金属锂所消耗的质量小
C.锂离子电池放电时电池内部Li+ 向负极移动
D.锂离子电池放电时C6Li 发生还原反应
14. 已知a、b分别为ⅠA和ⅦA族的同周期两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是( )
A. n=m+6 B. n=m+16 C. n=m+30 D. n=m+10
13. 向Fe2O3、CuO、Fe、Cu的混和粉未中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A. 只有Fe2+和Cu2+ B. 一定有Fe2+、Cu2+,可能有Fe3+
C. 一定有Fe2+,可能有Cu2+ D. 只有Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com