
题目列表(包括答案和解析)
22.在2L的密闭容器中放入4molN2O5,发生如下反应:
2N2O5(g) 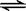 4NO2(g)+ O2(g)
4NO2(g)+ O2(g)
反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?(提示:8/13=0.6154)[
17(4分).在 11H,31H,2312Mg,168O,178O,188O中共有 种元素, 种原子,中子数最多的是 。2H218O的相对分子质量是 。
18(6分). A、B、C三种短周期元素,A是地壳中含量最多的元素,B的单质是最轻的气体,C的单质通常情况下是一种黄绿色的气体,该气体常用于自来水的杀菌消毒。请按要求填空:
①A的原子结构示意图为:
②用电子式表示 B2A的形成过程
③写出实验室用含C元素的化合物制取A的单质的化学方程式:
19( 10分). 现有如下两个反应:(A)NaOH + HCl = NaCl + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)(2分).根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A) (B)
(2)(2分).如果(A或B)不能,说明其原因
(3)(6分).如果(A或B)可以,则写出正、负极材料及其电极反应式。
负极: ;
 正极: ;
正极: ;
20(12分)下图转化关系中,A、B、
C、D、E都是短周期元素的单质,在
常温常压下A是固体,其余都是气体,
且C呈黄绿色。化合物H和I两种气
体相遇时产生白烟。化合物G的焰色
反应为黄色。反应①和②均在溶液中
进行。
请按要求回答下列问题。
(1)写出下列物质的化学式:D 、F 。
(2)反应①的离子方程式为 。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为 。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色。该反应的离子方程式为 。这说明单质C的氧化性 于单质碘(填“强”或“弱”)。
21.(10分). 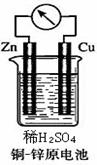 如右图所示的铜-锌原电池中,理论上应观察到的现象是:
如右图所示的铜-锌原电池中,理论上应观察到的现象是:
(1)
(2)
(3)
此时原电池的电极反应式是:
正极: 负极: 。
16、反应4A(g)+5B(g)  4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是 ( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是 ( )
A、A的平均反应速率是0.010 mol·L-1·s-1
B、容器中含D物质的量至少为0.45 mol
C、容器中C的物质的量一定为0.30 mol
D、容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
15.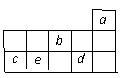 a、b、c、d、e为元素周期表前三周期中的部分元素,它们在元素周期表中的相对位置如右图所示。下列叙述正确的是( )
a、b、c、d、e为元素周期表前三周期中的部分元素,它们在元素周期表中的相对位置如右图所示。下列叙述正确的是( )
A、b元素除0价外只有一种化合价
B、五种元素中c的性质最稳定
C、d气态氢化物溶于水,溶液显碱性
D、e元素为15号元素
14. 化学反应A(g)+3B(g) 2C(g)+2D(g),下列四个选项是不同情况下测得的该反应以不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
化学反应A(g)+3B(g) 2C(g)+2D(g),下列四个选项是不同情况下测得的该反应以不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
A.υ(A)= 6 mol/(L·min) B.υ(B)=0.45 mol/(L·s)
C.υ(C)=0.40 mol/(L·s) D.υ(D)=0.35 mol/(L·s)
13.对于在密闭容器中、一定条件下进行的可逆反应N2 (g)+3 H2 (g) 2NH3 (g),能说明反应已达到平衡状态的是:( )
2NH3 (g),能说明反应已达到平衡状态的是:( )
A.各物质体积分数相等 B.c(NH3)保持不变
C.各物质浓度相等 D.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
12.下列装置属于原电池的是 ( )

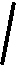
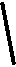

 Zn Cu Fe Fe Cu Ag Cu
Zn
Zn Cu Fe Fe Cu Ag Cu
Zn



酒精 CuCl2溶液 AgNO3溶液 稀硫酸 稀硫酸
A B C D
11.HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是:( )
A.CH4<H2O<HF<SiH4 B.SiH4<CH4<H2O<HF
C.SiH4<HF<CH4<H2O D.H2O<CH4<HF<SiH4
10.原电池中,正极是( )
A.物质被氧化的一极 B.电子流出的电极
C.发生还原反应的电极 C.与负极相比较,金属性较活泼的一极
9.用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
A.不用稀硫酸,改用98%浓硫酸 B.加热
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com