
题目列表(包括答案和解析)
5、对10mL1mol/L的盐酸与一小块大理石的化学反应:CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O,下列措施能使化学反应速率提高的是( )
A. 加入一定量的CaCl2
B. 加入5mL1.5mol/L的盐酸
C. 加入15mL0.5mol/L的盐酸
D. 加入5mLH2O
4、下列各组元素的原子随着原子序数的递增,有关递变关系错误的是( )
A.原子半径:Si > P > S > Cl B.最高正价:C < N < O < F
C.金属性:Na < K < Rb < Cs D.非金属性: P < S < Cl
3、下列反应中既属于氧化还原反应,又属于吸热反应的是( )
A. 铝片与稀盐酸反应
B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的碳与CO2反应
D. 甲烷在氧气中燃烧
2、下列化合物中既含有离子键又含有非极性共价键的化合物是( )
A.CaBr2 B.NaOH
C.Na2O2 D.H2O2
1、某主族元素原子的最外层电子数是次外层电子数的2倍,则该原子的质子数是( )
A. 4 B. 5 C. 6 D. 8
23.(8分)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。
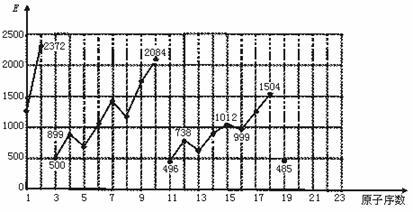
试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:_____________ ▲ _______。各主族中E值的这种变化特点体现了元素性质的____ ▲ ___变化规律。
(2)同周期内,随原子序数增大,E值增大,但个别元素的E值出现反常现象。下列关系式中正确的是_____ ▲ __ (填写编号,多选倒扣)
①E(氮)>E(碳) ②E(氮)<E(氧) ③E(氯)>E(硫) ④E(镁)<E(铝)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
___ ▲ ___<E<____ ▲ _____。
(4)10号元素E值较大的原因是___________________ ▲ ________________。
江苏省2009-2010学年度高一年级第二学期第一次检测
22.(8分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是 ▲ 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ▲ ;Y与E能形成的化合物电子式为 ▲ 。
(3)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与水反应的化学方程式为 ▲ 。
21.(6分)通常情况下,A、B、C、D、E五种微粒都含有10个电子,其中A和B为分子,C和E为阳离子,E原子核中含有13个质子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀F。请回答:
(1)用化学符号表示下列4种微粒:A___ ▲ ___;B__ ▲ ____;C___ ▲___;D___▲ ____。
(2)写出A、B、E三种微粒反应的离子方程式:________________ ▲ ____________。
20.(8分)(1)元素的化合价有一定的规律。某元素最高价氧化物的化学式为RO2,则其氢化物的分子式为 ▲ ,若R的简单气态氢化物中氢的质量分数为25%,R的原子核中质子数等于中子数,此元素是 ▲ 。
(2)元素周期表中同主族元素性质有一定相似性和递变性。高温超导体中铊(Tl)是有效成分之一,已知铊是铝的同族元素,是ⅢA族中核电荷数最大的元素,关于铊的性质判断可能错误的是 ▲ 。
A.铊是银白色质软的金属 B.铊能形成+3价的化合物
C.Tl(OH)3与Al(OH)3一样,一定具有两性 D.铊可以与稀硝酸反应生成硝酸盐
(3)已知下列元素的原子半径为
|
原 子 |
N |
S |
O |
Si |
|
半径r/(单位:nm) |
0.075 |
0.102 |
0.074 |
0.117 |
根据以上数据及原子半径的变化规律,磷原子的半径可能是 ▲ 。
A.0.110nm B.0.120nm C.0.080nm D.0.070nm
19.(9分)下表为元素周期表的一部分。
 族
周期 族
周期 |
ⅠA |
ⅡB |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
一 |
① |
|
|||||
|
二 |
② |
|
|
③ |
④ |
⑤ |
⑥ |
|
三 |
⑦ |
⑧ |
⑿ |
|
|
⑨ |
⑩ |
|
四 |
⑾ |
|
|
|
|
|
⒀ |
(1) 表中元素_ ▲ _的非金属性最强;元素__ ▲ __的金属性最强;元素__ ▲ __的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是____ ▲ __;
(3) 表中元素⑥⑨⑩氢化物的稳定性顺序为__ ▲ __>___ ▲ __>___ ▲ _(填写化学式,下同);
(4) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:___ ▲ ____>____ ▲ ___。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com