
题目列表(包括答案和解析)
4、下列用水就能鉴别的一组物质是
A.苯、己烷、四氯化碳 B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳 D.硝基苯、乙醇、乙酸
3、下列反应属于取代反应的是
A.乙烯通入酸性高锰酸钾溶液中
B.苯与液溴混合后撒入铁粉
C.在镍做催化剂的条件下,苯与氢气反应
D.乙烯通入溴水中
2、下列关于甲烷与氯气发生取代反应所得生成物的说法正确的是
A.都是有机物
B.都不溶于水
C.有一种气态物质,其余都是液体
D.有一种是无机物,其余都是有机物
1、科学家对土星的最大卫星--土卫六的探测数据分析发现,土卫六的大气层
中含有95% 的氮气,剩余的气体为甲烷和其它碳氢化合物。关于甲烷和碳氢
化合物的叙述错误的是 A.甲烷是含碳量最低的碳氢化合物 B.所有的碳氢化合物分子组成均符合Cn H2n+2的通式 C.碳氢化合物均不溶于水
D.碳氢化合物分子中的化学键一定有极性键,也可能有非极性键
26.某元素的同位素X,它的氯化物XCl 1.49g溶于水制成溶液后, 加入1mol·L-1的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,试通过计算确定(写出计算过程):¥高#考#资%源*网
(1)X元素在周期表中的位置;
(2)把一小粒X的单质放入水中,有何现象? 写出反应的化学方程式。
上杭一中2009-2010学年第二学期半期考试
25.(4分)已知元素的电负性是分子内一个原子吸引电子的能力,能力越大,电负性越大,非金属性越强。电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性
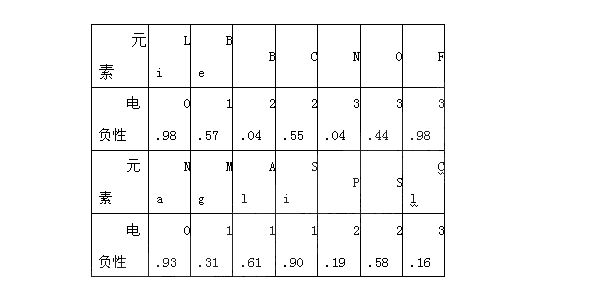
请结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是
(2)预测下列两组元素电负性的大小关系:K Ca ,Na K(填“大于”、“小于”或者“等于”)。
24. (10分)
(10分)
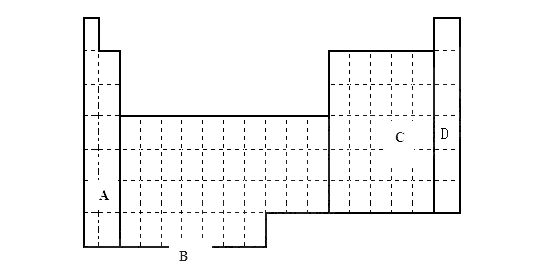
(1)(2分)在上面元素周期表中全部是金属元素的区域为 。
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等
①(2分) 用元素符号将甲乙两元素填写在上面元素周期表中对应的位置。
②(6分) 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
23.(8分)A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
|
A |
|
C |
|
D |
B |
E |
(1)写出三种元素名称A 、B 、C 。
(2)B元素位于元素周期表中第 周期, 族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示) ;E和Na 形成的化合物的电子式是 。
22. (5分)对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
(5分)对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
|
编 号 |
改变的条件 |
生成SO3的速率 |
|
① |
升高温度 |
|
|
② |
降低温度 |
|
|
③ |
增大O2的浓度 |
|
|
④ |
使用V2O5作催化剂 |
|
|
⑤ |
压缩体积 |
|
21.(4分)判断物质中化学键时应该注意一些问题,下列说法中正确的是
①存在离子键的化合物一定是离子化合物,离子化合物中一定存在离子键
②离子化合物可以只含非金属元素,也可以存在共价键,如NH4Cl
③共价化合物中只含有共价键,不含离子键 K^S*5U.C#
④非金属单质(稀有气体除外)中只含有共价键
⑤稀有气体由单原子组成,无化学键
⑥只含有共价键的化合物一定是共价化合物,只含有共价键的物质不一定是共价化合物,可能是单质;含有共价键的化合物不一定是共价化合物,可能是离子化合物,例如NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com