
题目列表(包括答案和解析)
20.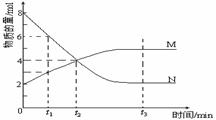 在一定温度下,容器内某一反应中M、N 的物质的量随反应时间变化的曲线如图,
在一定温度下,容器内某一反应中M、N 的物质的量随反应时间变化的曲线如图,
(1)反应的化学方程式为 。
(2)t1、t2 、t3时刻中已达平衡状态的是 。(填t1、t2 、t3)
19.已知拆开1 mol H-H键、1 mol N≡N、1 mol N-H键分别需要吸收的能量为436kJ、946k J、391k J。则由1 mol氮气完全反应生成NH3需要 (填“放出”或“吸收”) k J的热量。
18.将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(“锌”、“铜”),
铜极发生的电极反应方程式是 ,[
该电池的总反应的离子方程式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上反应的电极反应方程式是 ,
17. 原子的中子数和电子数的差值为______, NaCl的电子式为 ,S的原子结构示意图为 。
原子的中子数和电子数的差值为______, NaCl的电子式为 ,S的原子结构示意图为 。
16.一定条件下,反应A + 2B  2C在2L的容器中进行,5分钟内A的物质的量减少2mol,则在这段时间内用A表示的反应速率是( )
2C在2L的容器中进行,5分钟内A的物质的量减少2mol,则在这段时间内用A表示的反应速率是( )
A.0.1mol/(L.min)B.2mol/(L.min)C.0.4 mol/(L.min) D.0.2 mol/(L.min)
15.下列化合物中,既有离子键又有共价键的是( )
A.NH4Cl B.MgO C.C2H6 D.CO2
14.甲、乙、丙、丁分别是Al2(SO4) 3、FeSO4、NaOH、BaCl2四种物质中的一种.若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失.丁溶液滴入甲溶液时,无明显现象发生.据此可推断丙物质的是( )
A.Al2(SO4) 3 B.FeSO4 C.NaOH D.BaCl2
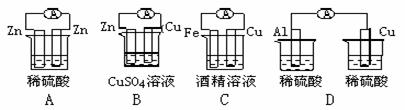
13.下列各个装置中能组成原电池的是 ( )
12.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路扳。向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中有铜,无铁 B.烧杯中铁、铜都无
C.烧杯中铜、铁都有 D.烧杯中有铁,无铜
11.在一定温度下,可逆反应A(g)+3B(g)
 2C(g)达到平衡状态的标志是( )
2C(g)达到平衡状态的标志是( )
A. C生成的速率与A消耗的速率相等
B. 单位时间生成n mol A,同时生成3n mol B
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1∶3∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com